
分析 向一個體積可變的密閉容器中充入3mol A、1mol B,在T°C時達到平衡,測得混合氣體中D的物質的量為2.0mol,則:
3A(g)+B(s)?2C(s)+3D(g)
起始量(mol):3 0
變化量(mol):2 2
平衡量(mol):1 2
(1)根據v=$\frac{△c(D)}{△t}$計算v(D),A的轉化率=$\frac{反應的A的物質的量}{A的起始物質的量}$×100%,反應前后氣體的物質的量不變,用物質的量代替濃度代入K=$\frac{{c}^{3}(D)}{{c}^{3}(A)}$計算平衡常數;
(2)增大壓強反應速率增大,反應前后氣體的化學計量數不變,平衡不移動;
(3)反應氣體混合氣體總的物質的量不變,溫度升高時混合氣體的平均相對分子質量減小,說明升高溫度,混合氣體的總質量減小,由于相對分子質量M(B)<2M(C),故升高溫度平衡向正反應方向移動;
(4)設轉化時D為xmol,表示出平衡時A、D的物質的量,根據平衡常數列方程,再計算平衡時D的物質的量,再根據V=$\frac{n}{c}$計算體積.
解答 解:向一個體積可變的密閉容器中充入3mol A、1mol B,在T°C時達到平衡,測得混合氣體中D的物質的量為2.0mol,則:
3A(g)+B(s)?2C(s)+3D(g)
起始量(mol):3 0
變化量(mol):2 2
平衡量(mol):1 2
(1)v(D)=$\frac{\frac{2mol}{10L}}{2min}$=0.1mol/(L.min),A的轉化率=$\frac{2mol}{3mol}$×100%=66.7%,反應前后氣體的物質的量不變,用物質的量代替濃度計算平衡常數,則K=$\frac{{c}^{3}(D)}{{c}^{3}(A)}$=$\frac{{2}^{3}}{{1}^{3}}$=8,
故答案為:0.1mol/(L.min);66.7%;8;
(2)增大壓強正、逆反應速率都增大,反應前后氣體的化學計量數不變,平衡不移動,容器中D的體積分數不變,
故答案為:增大;不變;
(3)反應氣體混合氣體總的物質的量不變,溫度升高時混合氣體的平均相對分子質量減小,說明升高溫度,混合氣體的總質量減小,由于相對分子質量M(B)<2M(C),故升高溫度平衡向正反應方向移動,則正反應為吸熱反應,
故答案為:吸熱;
(4)設轉化時D為xmol,則:
3A(g)+B(s)?2C(s)+3D(g)
起始量(mol):0 6
變化量(mol):x x
平衡量(mol):x 6-x
則$\frac{(6-x)^{3}}{{x}^{3}}$=8,解得x=2,故平衡時D為(6-2)mol=4mol,故平衡時D濃度為1mol/L,則容器的體積=$\frac{4mol}{1mol/L}$=4L,
故答案為:4.
點評 本題考查化學平衡計算與影響因素、反應速率計算等,(4)中由于反應前后氣體的物質的量不變,壓強不影響平衡移動,可以利用等效平衡解答,難度中等.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:選擇題
| A. | 普通玻璃和鋼化玻璃的成分不一樣,鋼化玻璃中加了玻璃鋼 | |
| B. | 水泥的主要成分是硅酸二鈣、硅酸三鈣和鋁酸三鈣 | |
| C. | 水泥具有水硬性,因此在保存和運輸過程中要注意防水防潮 | |
| D. | 陶瓷的釉料在燒制時,若空氣過量,一般顯示的是高價態的金屬的顏色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 用3.2g含有一定雜質的鎂條與足量的稀硫酸反應制取氫氣(雜質不與硫酸反應),收集到氫氣2.24L(已折算到標準狀況下),再往反應后的溶液中滴加NaOH溶液,使鎂元素轉化成Mg(OH)2沉淀,發現生成的沉淀質量與加入NaOH溶液中NaOH的物質的量有如圖所示關系,試求:
用3.2g含有一定雜質的鎂條與足量的稀硫酸反應制取氫氣(雜質不與硫酸反應),收集到氫氣2.24L(已折算到標準狀況下),再往反應后的溶液中滴加NaOH溶液,使鎂元素轉化成Mg(OH)2沉淀,發現生成的沉淀質量與加入NaOH溶液中NaOH的物質的量有如圖所示關系,試求:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始時V(A)=V(B)=a L.在相同溫度和有催化劑的條件下,兩容器中各自發生下列反應:X(g)+Y(g)?2Z(g)+W(g);△H>0,達到平衡時,V(A)=1.1a L.
如圖所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始時V(A)=V(B)=a L.在相同溫度和有催化劑的條件下,兩容器中各自發生下列反應:X(g)+Y(g)?2Z(g)+W(g);△H>0,達到平衡時,V(A)=1.1a L.| A. | 反應開始時,B容器中化學反應速率比A容器中快 | |
| B. | A容器中X的轉化率為20%,且比B容器中X的轉化率小 | |
| C. | 打開K一段時間,達新平衡時,A的體積為2.3a L(連通管中氣體體積不計) | |
| D. | 打開K達新平衡時,升高B容器的溫度,A容器的體積會增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
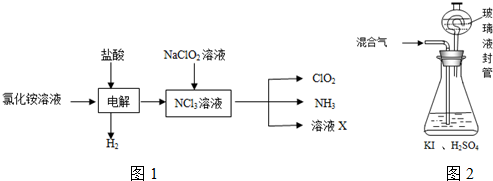
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
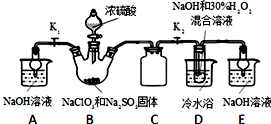
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸餾時,應使溫度計水銀球靠近蒸餾燒瓶支管口 | |
| B. | 在分液漏斗中用酒精萃取碘水中的碘,分液時下層液體從下口放出,上層液體從上口倒出 | |
| C. | 配制濃H2SO4和濃HNO3的混酸時,應將濃H2SO4慢慢加到濃HNO3中,并及時攪拌 | |
| D. | 用蒸發結晶的方法可使NaCl從溶液中析出 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com