
甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景。
(1)工業生產甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g)
△H = —90.8kJ/mol。
CH3OH(g)
△H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+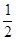 O2(g)=H2O(g)
△H = —241.8kJ/mol;
O2(g)=H2O(g)
△H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①計算液體CH3OH的燃燒熱為 。
②若在恒溫恒容的容器內進行反應CO(g)+2H2(g)
 CH3OH(g),下列表示該反應達到平衡狀態的標志有 (填字母序號)。
CH3OH(g),下列表示該反應達到平衡狀態的標志有 (填字母序號)。
A.有1個H—H鍵生成的同時有 3個C—H鍵生成
B.CO百分含量保持不變
C.容器中混合氣體的壓強不變化
D.容器中混合氣體的密度不變化
(2)制甲醇所需要的H2,可用下列反應制取:H2O(g)+CO(g)  H2(g)+
CO2(g) △H<0,某溫度下該反應的平衡常數K=1。若起始時c(CO)=1mol•L-1,c(H2O)=2mol•L-1,試回答下列問題:
H2(g)+
CO2(g) △H<0,某溫度下該反應的平衡常數K=1。若起始時c(CO)=1mol•L-1,c(H2O)=2mol•L-1,試回答下列問題:
①該溫度下,反應進行一階段時間后,測得H2的濃度為0.5mol•L-1,則此時該反應v(正) v(逆)(填“>”、“<”或“=”);
②若反應溫度不變,達到平衡后,H2O的轉化率為 。
(3)某實驗小組設計了如右圖7所示的甲醇燃料電池裝置。
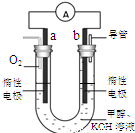
①該電池工作時,OH— 向 極移動(填“a”或“b”);
②工作一段時間后,測得溶液的pH減小,該電池負極反應的離子方程式為 。
(12分)
(1)726.5KJ/mol(2分) BC(2分)
(2)> (2分) 33.3% (2分)
(3)b(2分) CH3OH + 8OH- - 6e- = CO32- + 6H2O (2分)
【解析】
試題分析:
(1)①根據蓋斯定律把方式程式進行加減運算,得出結果為726.5。②A應該是有2個H—H鍵生成的同時有 3個C—H鍵生成;D.容器中混合氣體的密度始終不變化,無法做為判斷依據;(2)①通過運用三態法計算出此溫度下的平衡常數為K’=0.5*0.5/0.5*1.5=1/3<1,所以平衡正向移動,所以v(正)>v(逆)。②根據平衡常數K=1,運用三態法計算出H2O的轉化率為33.3%。
(3)①該電池工作時,OH— 向負極移動,由于O2在正極參加反應,所以b極應該是負極。②負極中首先清楚是甲醇失去電子生成CO2,但由于電解質溶液呈堿性所以產物中應該有CO32-生成。所以電極反應式為CH3OH + 8OH- - 6e- = CO32- + 6H2O (2分)。
考點:考查蓋斯定律,平衡狀態的判斷和電化學相關知識。


科目:高中化學 來源: 題型:
 (2012?汕頭二模)甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景.
(2012?汕頭二模)甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景.| 1 |
| 2 |
| 催化劑 |
| 加熱 |
| 催化劑 |
| 加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景.
甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景.| 1 | 2 |
查看答案和解析>>
科目:高中化學 來源:2012屆江蘇省南通市高三上學期期末調研測試化學試卷 題型:填空題
(15分)甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景。
⑴工業生產甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) +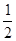 O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃燒熱為 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反應熱△H= ▲ 。
CO(g)+2H2O(g)的反應熱△H= ▲ 。
③若在恒溫恒容的容器內進行反應CO(g)+2H2(g) CH3OH(g),則可用來判斷該反應達到平衡狀態的標志有 ▲ 。(填字母)
CH3OH(g),則可用來判斷該反應達到平衡狀態的標志有 ▲ 。(填字母)
| A.CO百分含量保持不變 |
| B.容器中H2濃度與CO濃度相等 |
| C.容器中混合氣體的密度保持不變 |
| D.CO的生成速率與CH3OH的生成速率相等 |
 CO(g)+2H2(g),此反應能自發進行的原因是 ▲ 。
CO(g)+2H2(g),此反應能自發進行的原因是 ▲ 。 
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省南通市高三上學期期末調研測試化學試卷 題型:填空題
(15分)甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景。
⑴工業生產甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) + O2(g)
= H2O(g) △H=-241.8 kJ/mol
O2(g)
= H2O(g) △H=-241.8 kJ/mol
①H2的燃燒熱為 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反應熱△H= ▲ 。
CO(g)+2H2O(g)的反應熱△H= ▲ 。
③若在恒溫恒容的容器內進行反應CO(g)+2H2(g) CH3OH(g),則可用來判斷該反應達到平衡狀態的標志有 ▲ 。(填字母)
CH3OH(g),則可用來判斷該反應達到平衡狀態的標志有 ▲ 。(填字母)
A.CO百分含量保持不變
B.容器中H2濃度與CO濃度相等
C.容器中混合氣體的密度保持不變
D.CO的生成速率與CH3OH的生成速率相等
⑵工業上利用甲醇制備氫氣的常用方法有兩種:
①甲醇蒸汽重整法。該法中的一個主要反應為CH3OH(g) CO(g)+2H2(g),此反應能自發進行的原因是 ▲ 。
CO(g)+2H2(g),此反應能自發進行的原因是 ▲ 。
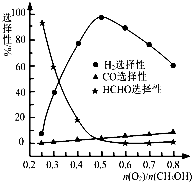
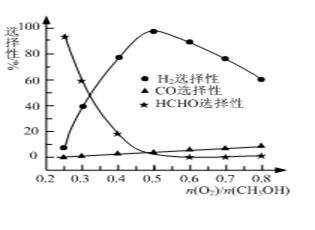
②甲醇部分氧化法。在一定溫度下以Ag/CeO2—ZnO為催化劑時原料氣比例對反應的選擇性(選擇性越大,表示生成的該物質越多)影響關系如圖所示。則當n(O2)/n(CH3OH)=0.25時,CH3OH與O2發生的主要反應方程式為 ▲ ;在制備H2時最好控制n(O2)/n(CH3OH)= ▲ 。
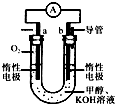
⑶在稀硫酸介質中,甲醇燃料電池負極發生的電極反應式為 ▲ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com