
已知25℃時部分弱電解質的電離平衡常數數據如表所示:
| 化學式 | CH3COOH | H2CO3 | HClO | |
| 電離平衡常數 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |

(1)a<d<c<b (1分)
(2)BD(2分)
(3)大于(1分) 稀釋相同倍數,一元酸HX的pH變化比CH3COOH的大,故HX酸性較強,電離平衡常數較大 (2分)
(4)9.9×10-7 (2分)
(5) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(2分)
解析試題分析:(1)四種溶液中,只有CH3COOH是酸,顯示酸性,水解程度:CO32﹣>ClO﹣>HCO3﹣,水解均顯堿性,水解程度越大,堿性越強,所以堿性順序是:Na2CO3>NaClO>NaHCO3,即pH由小到大的排列順序是CH3COOH<NaHCO3<NaClO<Na2CO3,故答案為:adcb;(2)A、0.1mol?L﹣1的CH3COOH溶液加稀釋過程中,電離程度增大,各個微粒濃度減小,故A錯誤;B、0.1mol?L﹣1的CH3COOH溶液加稀釋過程中,各個微粒濃度減小,同時醋酸的電離向右移動,c(H+)減小的程度小于c(CH3COOH)的減小程度,所以c(H+)/c(CH3COOH)增大,故B正確;C、Kw=c(H+)?c(OH﹣)只受溫度的影響,溫度不變則其值是一個常數,故C錯誤;D、醋酸稀釋,酸性減弱,c(H+)減小,堿性增強,c(OH﹣)增大,即c(OH﹣)/c(H+)增大,故D正確,故選BD。(3)根據CH3COOH與一元酸HX加水稀釋過程中pH與溶液體積的關系圖可以看出HX酸在稀釋過程中溶液的PH變化比醋酸的大,所以酸性HX強于醋酸,電離程度:HX>CH3COOH,故答案為:大于;稀釋相同倍數,一元酸HX的pH變化比醋酸大,故酸性強,電離平衡常數大;(4)CH3COOH與CH3COONa的混合溶液中,存在電荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),所以c(CH3COO﹣)﹣c(Na+)=c(H+)﹣c(OH﹣)=10﹣6mol/L﹣10﹣8mol/L=9.9×10﹣7mol/L。(5)標準狀況下,將1.12L CO2是0.05mol,和 0.075mol的NaOH反應后生成碳酸鈉和碳酸氫鈉的混合溶液,兩都都為0.025mol,溶液呈堿性,由于碳酸根的水解生成碳酸氫根的程度較大,則溶液中離子的濃度由大到小的順序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
考點:本題考查有關弱電解質的電離知識。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
化學學科中的化學平衡、電離平衡、水解平衡和溶解平衡均符合勒夏特列原理。請回答下列問題:
(1)常溫下,取pH=2的鹽酸和醋酸溶液各100 mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示。則圖中表示醋酸溶液中pH變化曲線的是________(填“A”或“B”)。設鹽酸中參加反應的Zn粒質量為m1,醋酸溶液中參加反應的Zn粒質量為m2,則m1________m2(選填“<”、“=”或“>”)。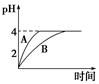
(2)已知常溫下Cu(OH)2的Ksp=2×10-20。又知常溫下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,則應調整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀較為完全(使Cu2+濃度降至原來的千分之一),則應向溶液里加NaOH溶液,使溶液pH為________。
(3)10 ℃時加熱NaHCO3飽和溶液,測得該溶液的pH發生如下變化:
| 溫度/℃ | 10 | 20 | 30 | 加熱煮沸后冷卻到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
常溫下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計)。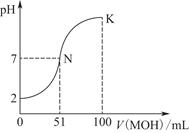
回答下列問題:
(1)由圖中信息可知HA為________酸(填“強”或“弱”),理由是________________________________________________。
(2)常溫下一定濃度的MA稀溶液的pH=a,則a________________________________________________________7
(填“>”“<”或“=”),用離子方程式表示其原因為_____________________________________________________
此時,溶液中由水電離出的c(OH-)=________。
(3)請寫出K點所對應的溶液中離子濃度的大小關系:_________________________________________。
(4)K點對應的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”“<”或“=”);若此時溶液中,pH=10,則c(M+)-c(OH-)=________mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
亞磷酸(H3PO3)是二元酸,與足量NaOH溶液反應生成Na2HPO3。
(1)PCl3水解可制取亞磷酸:PCl3+3H2O===H3PO3+________。
(2)H3PO3溶液中存在電離平衡:H3PO3 H++H2PO3—。
H++H2PO3—。
①某溫度下,0.10 mol·L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×
10-2 mol·L-1。求該溫度下上述電離平衡的平衡常數K,寫出計算過程。(H3PO3的第二步電離忽略不計,結果保留兩位有效數字)
②根據H3PO3的性質可推測Na2HPO3稀溶液的pH________7(填“>”“=”或“<”)。
(3)亞磷酸具有強還原性,可使碘水褪色。該反應的化學方程式為________。
(4)電解Na2HPO3溶液也可得到亞磷酸,裝置示意圖如下:
①陰極的電極反應式為________________________;
②產品室中反應的離子方程式為_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)物質的量濃度相同的三種鹽NX、NaY、NaZ的溶液,其pH依次為8、9、1 0,則HX、HY、HZ的酸性由強到弱的順序是 。
(2)比較下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液 0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液 0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四塊金屬片浸泡在稀H2SO4中,用導線兩兩相連,可以組成各種原電池。若a、b相連,a為負極;c、d相連,c為負極;a、c相連,c為正極;b、d相連,b為正極,則這四種金屬的活動性由強到弱的順序為 。
(4)將AlCl3溶液蒸干、灼燒,最后所得的固體的主要成份是 。
(5)氯化鐵溶液呈 性(填“酸”、“堿”或“中”),原因是(用離子方程式表示):
(6)向明礬溶液中逐滴加入Ba(OH)2溶液至SO42-剛好沉淀完全時,溶液的pH 7(填“>”“<”或“=”),離子反應總方程式為: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
常溫下,將0.05 mol·L-1鹽酸溶液和未知濃度的NaOH溶液以1:2的體積比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反應生成NaA。
(1)此一元弱酸的物質的量濃度為 ;
(2)此條件下該一元弱酸的電離平衡常數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)如圖是甲烷燃料電池原理示意圖,回答下列問題: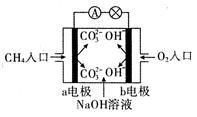
①電池的負極是 (填“a”或“b” )極,該極的電極反應式是 。
② 電池工作一段時間后電解質溶液的pH (填“增大”、“減小”或“不變”)。
(2)利用甲烷燃料電池及下圖所示的裝置完成電解飽和食鹽水的實驗,要求測定產生的氫氣的體積,并檢驗氯氣的氧化性。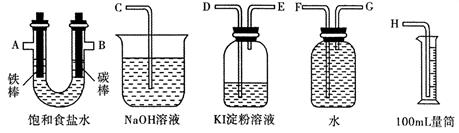
①設計上述實驗裝置時,各接口的正確連接順序為: 接 、 接 A 、 B 接 、 接 。
②實驗中,在盛有 KI 淀粉溶液的容器中發生反應的離子方程式為 。
③已知飽和食鹽水50mL,某時刻測得 H2體積為56mL (標準狀況),此時溶液 pH 約為
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)常溫下,將NH3·H2O與鹽酸等體積混合,實驗數據如下:
| 組別 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
求下列混合后溶液的pH:(lg2=0.3 lg5=0.7)
(1)把pH=2和pH=4的兩種強酸溶液等體積混合,其pH=_______。
(2)把pH=12和pH=14的兩種強堿溶液等體積混合,其pH=_________。
(3)把pH=2的H2SO4溶液和pH=10的NaOH溶液等體積混合,其pH=_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com