
| 時間/min | c(CO) | c(H2O)(g) | c(CO2) | c(H2) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
分析 (1)①2C3H8(g)+7O2(g)=6CO(g)+8H2O (l)△H1=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根據蓋斯定律書將方程式$\frac{①+3×②}{2}$計算得到其熱化學反應方程式;
(2)燃料電池中,負極上燃料失電子發生氧化反應,電解質內部陽離子向正極移動、陰離子向負極移動;
(3)①可逆反應達到平衡狀態時,正逆反應速率相等,各物質濃度、百分含量等都不變;
②2min內用CO表示的該反應速率v=,$\frac{0.20mol/L-0.138mol/L}{2min}$=0.031 mol/(L•min),溫度和體積不變時,第4~5min之間,平衡向逆反應方向移動,改變的條件為增加H2濃度是;由表可知第5~6min之間,增加H2O(g)濃度;第3min時達到平衡,T℃時該化學反應的平衡常數K=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.100×0.100}{0.100×0.200}$=0.5,
CO (g)+H2O(g)?CO2(g)+H2 (g)
起始量(mol/L) 0.2 0.3 0 0
變化量(mol/L) 0.1 0.1 0.1 0.1
平衡量(mol/L) 0.1 0.2 0.1 0.1
4min時保持其它條件不變,向上述平衡體系中加入0.1molCO、0.1molCO2、0.1molH2,計算濃度商Qc和平衡常數比較判斷反應進行的方向;
③420℃時,設參加反應的CO的濃度為x,則K=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{x×x}{(0.01-x)(0.01-x)}$=9,解之得x=0.0075mol/L,則在此條件下的轉化率=$\frac{消耗量}{起始量}$×100%;397℃時該反應的平衡常數為12,降低溫度平衡向正反應方向移動;
解答 解:(1)①2C3H8(g)+7O2(g)=6CO(g)+8H2O (l)△H1=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
將方程式$\frac{①+3×②}{2}$得C3H8(g)+5O2(g)=3CO2(g)+4H2O (l)△H=$\frac{-2741.8+3×(-566)}{2}$kJ/mol=-2219.9kJ/mol,
故答案為:-2219.9kJ/mol;
(2)該燃料電池中,負極上燃料失電子發生氧化反應,所以負極上通入的氣體是丙烷,電解質內部陽離子向正極移動、陰離子向負極移動,則氧離子向負極移動,
負極反應式為C3H8+10O2--20e-=3CO2+4H2O,
故答案為:B;
(3)①a.該反應前后氣體計量數之和不變,所以壓強始終不變,不能根據壓強確定反應是否達到平衡狀態,故a錯誤;
b.反應速率之比等于化學方程式計量數之比,始終存在v 正(H2)=v 正(CO),υ正(H2)=υ逆(CO)說明一氧化碳正逆反應速率相同,能據此判斷平衡狀態,故b正確;
c.該反應中氣體總質量不變、氣體物質的量不變,所以相對分子質量始終不變,所以不能據此判斷平衡狀態,故c錯誤;
d.CO2的濃度不再發生變化時,該反應達到平衡狀態,故d正確;
故選b d,
故答案為:bd;
②2min內用CO表示的該反應速率v=,$\frac{0.20mol/L-0.138mol/L}{2min}$=0.031 mol/(L•min),溫度和體積不變時,第4~5min之間,平衡向逆反應方向移動,改變的條件為增加H2濃度是;由表可知第5~6min之間,增加H2O(g)濃度;第3min時達到平衡,T℃時該化學反應的平衡常數K=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.100×0.100}{0.100×0.200}$=0.5,
CO (g)+H2O(g)?CO2(g)+H2 (g)
起始量(mol/L) 0.2 0.3 0 0
變化量(mol/L) 0.1 0.1 0.1 0.1
平衡量(mol/L) 0.1 0.2 0.1 0.1
4min時保持其它條件不變,向上述平衡體系中加入0.1molCO、0.1molCO2、0.1molH2,計算濃度商Qc=$\frac{(0.1+0.1)×(0.1+0.1)}{(0.1+0.1)×0.2}$=1>k=0.5,反應逆向進行,
故答案為:0.031 mol/(L•min);逆;
③420℃時,設參加反應的CO的濃度為x,則K=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{x×x}{(0.01-x)(0.01-x)}$=9,解之得x=0.0075mol/L,則在此條件下的轉化率為$\frac{0.0075mol/L}{0.01mol/L}$×100%=75%,397℃時該反應的平衡常數為12,降低溫度平衡向正反應方向移動,則正反應為放熱反應<0,
故答案為:75%;<.
點評 本題考查較綜合,涉及原電池原理、化學平衡狀態的判斷、蓋斯定律等知識點,難點是平衡狀態的判斷、電極反應式書寫,注意“只有反應前后改變的物理量”才能作為平衡狀態的判斷依據,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 | 元素性質或原子結構的相關敘述 |
| T | 失去一個電子后,形成與Ne相同的核外電子排布 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 其某種單質是空氣的主要成分,也是最常見的助燃劑 |
| Z | 原子核外有3個電子層,最外層比次外層少1個電子 |
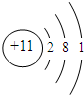 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化銅與稀鹽酸反應 O2-+2H+═H2O | |
| B. | 向碳酸氫鈉溶液中滴加稀鹽酸:HCO3-+H+═H2O+CO2↑ | |
| C. | 氫氧化鋇溶液和稀硫酸反應:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向澄清石灰水中通入少量CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 利用I2O5可消除CO污染或定量測定CO,反應為:
利用I2O5可消除CO污染或定量測定CO,反應為:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com