
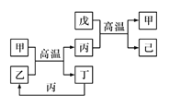
【題目】X、Y、Z、W是原子序數依次增大的前四周期元素,X、Z的周期序數=族序數,由這四種元素組成的單質或化合物存在如圖所示的轉化關系,其中甲、戊是兩常見的金屬單質,丁是非金屬單質,其余為氧化物且丙為具有磁性的黑色晶體。下列說法正確的是
A. W的原子序數是Z的兩倍,金屬性強于Z
B. W元素在周期表中的位置是第四周期VIII族
C. 丙屬于兩性氧化物
D. 等物質的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量一定相等
【答案】B
【解析】
X、Y、Z、W是原子序數依次增大的前四周期元素,X、Z的周期序數=族序數,則X是H元素,Z是Al元素;由這四種元素組成的單質或化合物存在如圖所示轉化關系,其中甲、戊是兩常見的金屬單質,丁是非金屬單質,其余為氧化物且丙為具有磁性的黑色晶體,則丙是Fe3O4,結合元素及化合物的性質逆推可知甲為Fe,乙為H2O,丁是H2,戊為金屬單質,可以與Fe3O4反應產生Fe單質,因此戊是Al單質,己為Al2O3,結合原子序數的關系可知Y是O元素,W是Fe元素,據此分析解答。
綜上所述可知X是H元素,Y是O元素,Z是Al元素,W是Fe元素。甲是Fe單質,乙是H2O,丙是Fe3O4,丁是H2,戊是Al單質,己是Al2O3。
A.Fe原子序數是26,Al原子序數是13,26為13的2倍,金屬性Al>Fe,A錯誤;
B.Fe是26號元素,在元素周期表中位于第四周期VIII族,B正確;
C.丙是Fe3O4,只能與酸反應產生鹽和水,不能與堿發生反應,因此不是兩性氧化物,C錯誤;
D.Fe是變價金屬,與硝酸反應時,二者的相對物質的量的多少不同,反應失去電子數目不同,可能產生Fe2+,也可能產生Fe3+,而Al是+3價的金屬,因此等物質的量的甲和戊完全溶于稀硝酸,消耗的HNO3的量不一定相等,D錯誤;
故合理選項是B。


 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:
【題目】鈉及它們的化合物在生產、生活中有著重要的用途。
Ⅰ.碳酸氫鈉可做安全氣囊中的冷卻劑,吸收產氣過程中釋放的熱量而分解,其分解的化學方程式是___。
Ⅱ.高壓鈉燈發光效率高、穿透力強、耗電少,壽命長。這種燈發出的光為___色。
Ⅲ.過氧化鈉是重要的工業漂白劑。某課外活動小組設計了下列裝置,驗證二氧化碳跟過氧化鈉反應時需要與水接觸。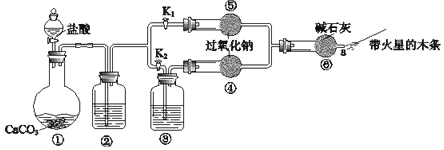
(1)(裝置分析)
①裝置①中反應的離子方程式是___。
②裝置②中的試劑是___(填序號)。
a.飽和NaHCO3溶液 b.飽和Na2CO3溶液 c.濃H2SO4
③裝置③中的試劑是___。
(2)(進行實驗)
步驟1:打開彈簧夾K2,關閉K1,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在a處。
步驟2:打開彈簧夾K1,關閉K2,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在a處。
①步驟1和步驟2中,a處帶火星的木條產生的實驗現象分別是___。
②過氧化鈉跟二氧化碳反應的化學方程式是__。
(3)(實驗反思)
①有同學提出質疑:“上述實驗不足以證明有水存在時過氧化鈉跟二氧化碳發生了化學反應。”其理由是__。
②需要補充的實驗操作是:取⑤中反應后的少量固體,___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,縱坐標表示電導率,橫坐標表示所加溶液的量,以下各組反應符合該圖的是(不考慮溶液混合體積的變化)( )
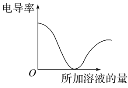
A.向Ba(OH)2溶液中滴加稀H2SO4
B.向NaOH溶液中滴加稀HCl
C.向純水中加入NaCl溶液
D.向KCl溶液中滴加NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A. ![]() 固體含有離子的數目為
固體含有離子的數目為![]()
B. 常溫下,![]() 的醋酸溶液中H+數目為
的醋酸溶液中H+數目為![]()
C. 13g由![]() C和
C和![]() 組成的碳單質中所含質子數一定為
組成的碳單質中所含質子數一定為![]()
D. ![]() 與足量
與足量![]() 在一定條件下化合,轉移電子數為
在一定條件下化合,轉移電子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制備氯氣并驗證氯氣性質的裝置(其中夾持裝置已省略)。
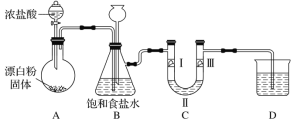
已知:裝置A是氯氣的發生裝置,反應的化學方程式為Ca(ClO)2+4HCl(濃)=CaCl2+2Cl2↑+2H2O。據此回答下列問題:
(1)裝置B中飽和食鹽水的作用是________;長頸漏斗的作用是__________。
(2)裝置C的作用是驗證氯氣是否具有漂白性,則裝置C中Ⅰ、Ⅱ、Ⅲ處依次應放入的物質是: 濕潤的有色布條、 無水氯化鈣、干燥的有色布條,請你推測Ⅰ、Ⅲ處的現象依次為:______,_____。
(3)裝置D的作用是___________,則燒杯中的溶液是______,寫出所發生反應的化學方程式: ________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應中的能量變化是由化學反應中舊化學健斷裂時吸收的能量與化學健形成時放出的能量不同引起的。如圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化,下列說法中正確的是

A. 1molN2(g)和1molO2(g)反應放出的能量為180kJ
B. 1molN2(g)和1molO2(g)具有的總能量小于2molNO(g)具有的總能量
C. 在1L的容器中發生反應.10min內N2減少了1mol,因此10min內的平均反應速率為v(NO)=0.1mol/(L·min)
D. NO是一種酸性氧化物,能與NaOH溶液反應生成鹽和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面有關化學反應速率和限度的圖像和實驗結論表達均正確的是( )
A.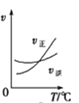 A(g)+3B(g)2C(g),如圖是其他條件一定時反應速率隨溫度變化的圖像,圖像表明,較低溫度下升溫平衡逆向移動,較高溫度下升溫平衡正向移動
A(g)+3B(g)2C(g),如圖是其他條件一定時反應速率隨溫度變化的圖像,圖像表明,較低溫度下升溫平衡逆向移動,較高溫度下升溫平衡正向移動
B.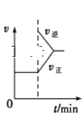 FeCl3+3KSCNFe(SCN)3+3KCl,如圖是在平衡體系的溶液中加入少量KCl晶體后化學反應速率隨時間的變化
FeCl3+3KSCNFe(SCN)3+3KCl,如圖是在平衡體系的溶液中加入少量KCl晶體后化學反應速率隨時間的變化
C.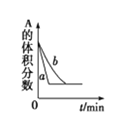 A(g)+3B(g)2C(g),如圖可能是催化劑對化學平衡的影響,也可能是其它因素對化學平衡的影響
A(g)+3B(g)2C(g),如圖可能是催化劑對化學平衡的影響,也可能是其它因素對化學平衡的影響
D.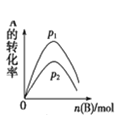 A(g)+3B(g)2C(g),如圖是一定條件下,向含有一定量A的容器中逐漸加入B時的圖像,壓強p1>p2
A(g)+3B(g)2C(g),如圖是一定條件下,向含有一定量A的容器中逐漸加入B時的圖像,壓強p1>p2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫及其化合物有許多用途,相關物質的物理常數如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔點/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸點/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列問題:
(1)基態Fe原子價層電子的電子排布圖(軌道表達式)為__________,基態S原子電子占據最高能級的電子云輪廓圖為_________形。
(2)根據價層電子對互斥理論,H2S、SO2、SO3的氣態分子中,中心原子價層電子對數不同于其他分子的是_________。
(3)圖(a)為S8的結構,其熔點和沸點要比二氧化硫的熔點和沸點高很多,主要原因為__________。
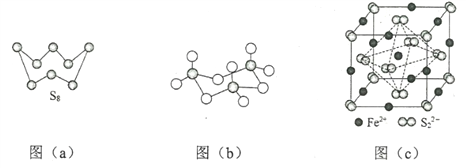
(4)氣態三氧化硫以單分子形式存在,其分子的立體構型為_____形,其中共價鍵的類型有______種;固體三氧化硫中存在如圖(b)所示的三聚分子,該分子中S原子的雜化軌道類型為________。
(5)FeS2晶體的晶胞如圖(c)所示。晶胞邊長為a nm、FeS2相對式量為M,阿伏加德羅常數的值為NA,其晶體密度的計算表達式為___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面體的體心,該正八面體的邊長為______nm。
所形成的正八面體的體心,該正八面體的邊長為______nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于放熱反應Zn+H2SO4=ZnSO4+H2↑,下列敘述正確的是( )
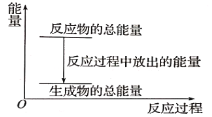
A. 反應過程中的能量關系可用上圖表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若將其設計為原電池,則其能量轉化形式為電能轉化為化學能
D. 若將其設計為原電池,當有32.5gZn溶解時,正極放出的氣體一定為11.2L.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com