
分析 (1)①同一周期元素從左到右電負性逐漸增大;
②CO在常溫下為氣態,符合分子晶體的性質;
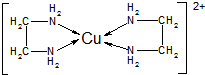
(2)Cu+有2個空的sp雜化軌道,NH3分子中的N原子有一孤電子對,進入Cu+空的sp雜化軌道,以配位鍵形成直線形結構;
(3)①根據核外電子排布規律書寫Cu原子的核外電子排布式,電子按能層高低進行失去,進而書寫Cu2+的外圍電子排布式;
②乙二胺(H2N-CH2-CH2-NH2)中N原子呈3個σ鍵,含有1對孤對電子,雜化軌道數為4,采取sp3雜化;
乙二胺(H2N-CH2-CH2-NH2)分子之間可以形成氫鍵,但三甲胺[N(CH3)3]分子之間不能形成氫鍵;
③離子中存在配位鍵、C-N鍵、C-H鍵、N-H鍵、C-C鍵,據此判斷離子化學鍵類型.
解答 解:(1)①同一周期元素從左到右電負性逐漸增大,故電負性C<O,故答案為:<;
②CO在常溫下為氣態,符合分子晶體的性質,所以CO固態時是分子晶體,故答案為:分子;
(2)Cu+有2個空的sp雜化軌道,NH3分子中的N原子有一孤電子對,進入Cu+空的sp雜化軌道,以配位鍵形成直線形結構,則[Cu(NH3)n]+中Cu+與2個氮原子形成配位鍵,故答案為:直線;2;
(3)①Cu原子的核外電子排布式為1s22s22p63s23p63d104s1,故Cu2+的外圍電子排布式為3d9,故答案為:3d9;
②乙二胺(H2N-CH2-CH2-NH2)中N原子呈3個σ鍵,含有1對孤對電子,雜化軌道數為4,采取sp3雜化.
乙二胺(H2N-CH2-CH2-NH2)分子之間可以形成氫鍵,三甲胺[N(CH3)3]分子之間不能形成氫鍵,故乙二胺的沸點較高.
故答案為:sp3雜化;乙二胺分子之間可以形成氫鍵,三甲胺分子之間不能形成氫鍵;
③離子中存在配位鍵、C-N鍵、C-H鍵、N-H鍵、C-C鍵,其中C-N鍵、C-H鍵、N-H鍵為極性鍵,C-C鍵為非極性鍵,故離子含有配位鍵、極性鍵、非極性鍵,故選ABD,故答案為:ABD.
點評 本題考查核外電子排布規律、雜化軌道、分子空間結構、氫鍵與化學鍵等,綜合性較大,難度中等,是對知識的綜合運用,需要學生具備扎實的基礎與分析問題解決問題的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:多選題
| A. | 電離時能生成H+的化合物一定是酸 | |
| B. | 堿在電離時一定有OH-生成 | |
| C. | 因為硫酸由H+和SO42-構成,故電離時能生成H+和SO42- | |
| D. | 氫氧化鈉在水溶液中和熔化時都能發生電離 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 丙泊酚,其化學名為2,6-雙異丙基苯酚,是目前臨床上普遍用于麻醉誘導、麻醉
丙泊酚,其化學名為2,6-雙異丙基苯酚,是目前臨床上普遍用于麻醉誘導、麻醉| A. | 分子式為C10H20O | |
| B. | 分子中所有碳原子可能在同一平面中 | |
| C. | 該物質的1H核磁共振譜圖中有5個特征峰,峰值強度比大概為:1:1:2:2:12 | |
| D. | 該物質結構中有2個手性碳原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其酸性比乙酸強.據此請回答:
,其酸性比乙酸強.據此請回答: COOH+2Na→NaO
COOH+2Na→NaO COONa+H2↑;將此反應生成的有機物溶于適量的水中形成溶液,向該溶液中通入足量的二氧化碳,則這時又可生成的有機物的結構簡式為HO
COONa+H2↑;將此反應生成的有機物溶于適量的水中形成溶液,向該溶液中通入足量的二氧化碳,則這時又可生成的有機物的結構簡式為HO OONa.
OONa.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
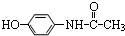 ,則有關它的性質錯誤的是( )
,則有關它的性質錯誤的是( )| A. | 與氫氧化鈉溶液共熱消耗2molNaOH | B. | 能與濃溴水發生取代反應 | ||
| C. | 不能使酸性高錳酸鉀溶液褪色 | D. | 遇三氯化鐵溶液呈現紫色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 短周期元素R、T、Q、W在元素周期表中的相對位置如圖所示,其中T所處的周期序數與族序數相等.下列說法不正確的是( )
短周期元素R、T、Q、W在元素周期表中的相對位置如圖所示,其中T所處的周期序數與族序數相等.下列說法不正確的是( )| A. | 最高價氧化物對應水化物的酸性:Q<W | |
| B. | 最簡單氣態氫化物的熱穩定性:R>Q | |
| C. | 原子半徑:T>Q>R | |
| D. | 含T的鹽溶液一定顯酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 既可以與Br2的CCl4溶液發生加成反應,又可以在光照下與Br2發生取代反應 | |
| B. | 既可以與FeCl3溶液發生顯色反應,又可以與NaHCO3溶液反應放出CO2氣體 | |
| C. | 既可以催化加氫,又可以使酸性KMnO4溶液褪色 | |
| D. | 1 mol該化合物最多可以與3 mol NaOH反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com