
【題目】下列有關物質的性質與用途具有對應關系的是( )
A.NH3具有還原性,可用作制冷劑B.SO2具有氧化性,可用于漂白紙張
C.FeCl3溶液具有酸性,可用于蝕刻銅制品D.Al(OH)3具有弱堿性,可用作胃酸中和劑
 全優考典單元檢測卷及歸類總復習系列答案
全優考典單元檢測卷及歸類總復習系列答案科目:高中化學 來源: 題型:
【題目】下列有關物質性質與用途具有對應關系的是( )
A.HNO3有酸性,可用于洗滌附有銀鏡的試管
B.氧化鐵粉末呈紅色,可用于制取鐵鹽
C.SiO2熔點很高,可用于制造坩堝
D.碳酸氫鈉能與堿反應,可用作食品膨松劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源問題是人類社會面臨的重大課題,甲醇是未來重要的綠色能源之一。
(1)利用工業廢氣CO2可制取甲醇,已知常溫常壓下下列反應的能量關系如圖:
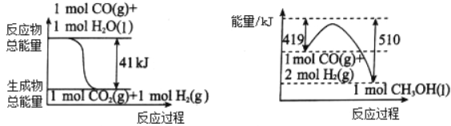
則CO2與H2反應生成CH3OH的熱化學方程式為_____________________
(2)CH4和H2O(g)通過下列轉化也可以制得CH3OH;
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g)![]() CH3OH(g) △H2<0
CH3OH(g) △H2<0
將1.0molCH4和3.0molH2O(g)通入反應室(容積為100L)中,在一定條件下發生反應I,CH4的轉化率與溫度、壓強的關系如下圖所示。
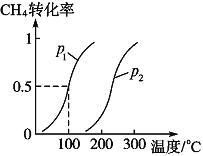
①已知溫度為T1℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率為________;
②圖中的p1_______p2(填“<”、“>”或“=”),判斷的理由是________________________。
③若反應Ⅱ在恒容密閉容器進行,下列能判斷反應Ⅱ達到平衡狀態的是_________(填序號)。
a.生成CH3OH的速率與消耗CO的速率相等
b.混合氣體的密度不變
c.混合氣體的總物質的量不變
d.CH3OH、CO、H2的濃度都不再發生變化
④在某溫度下,將一定量的CO和H2投入10L的密閉容器中發生反應II,5min時達到平衡,各物質的物質的濃度(mol·L﹣1)變化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min時只改變了某一條件,則所改變的條件是_____________;10min時測得各物質濃度如表,10min時v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學為人類的生產、生活提供了物質保證。下列工業生產原理不屬于化學變化的是( )
A.還原法冶煉生鐵B.分餾法提煉汽油
C.接觸法制取硫酸D.發酵法生產香醋
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】—定溫度下,將2 mol SO2和1mol O2充入10 L恒容密閉容器中,發生反應2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min時達到平衡,測得反應放熱166. 6 kJ。下列說法錯誤的是
2SO3(g) △H =-196 kJ mol-1。5 min時達到平衡,測得反應放熱166. 6 kJ。下列說法錯誤的是
A. 0~5 min內,用O2表示的平均反應速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不變時,該反應達到平衡狀態
的值不變時,該反應達到平衡狀態
C. 若增大O2的濃度,SO2的轉化率增大
D. 條件不變,若起始時充入4 mol SO2和2 mol O2,平衡時放出的熱量小于333.2 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學反應的敘述正確的是( )
A.常溫下Cu和濃硫酸反應生成CuSO4
B.過量的Fe與稀硝酸反應生成Fe(NO3)2
C.光照條件下,甲苯和Cl2反應生成鄰氯甲苯
D.加熱條件下,溴乙烷與NaOH水溶液反應生成乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖甲是利用一種微生物將廢水中的尿素[CO(NH2)2]的化學能直接轉化為電能,并生成環境友好物質的裝置,同時利用此裝置的電能在鐵上鍍銅。下列說法中正確的是
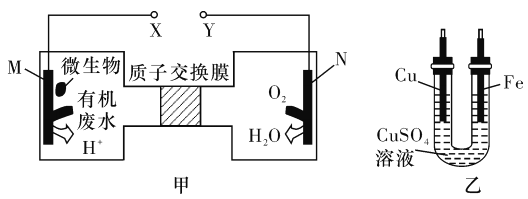
A. 銅電極應與X相連接
B. H+經過質子交換膜由右向左移動
C. 當N電極消耗0. 25 mol氣體時,則鐵電極增重16 g
D. M電極反應式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁元素含量居金屬首位, 主要存在于鋁土礦(主要成分為Al2O3,還含有Fe2O3、FeO、SiO2)中。鋁的單質及其化合物在生產、生活、科研等領城應用廣泛。
Ⅰ、工業上用鋁土礦制備鋁的某種化合物的工藝流程如下:
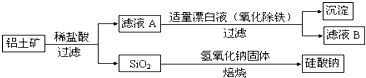
(1)在濾液A中加入漂白液,目的是氧化除鐵,所得濾液B顯酸性。
①該過程中涉及某氧化還原反應如下,請完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②檢驗濾液B中是否還含有鐵元素的方法為:_________________________
③將濾液B中的鋁元素以沉淀形式析出,可選用的最好試劑為__________(選填代號)
A.氫氧化鈉溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由濾液B制備氯化鋁晶體涉及的操作為:邊滴加濃鹽酸邊蒸發濃縮、__________(填操作名稱)、過濾、洗滌。
Ⅱ、明礬(KAl(SO4)2·12H2O)在日常生活、生產中也占有一席之地。
(1)明礬曾經是凈水明星,用離子方程式表示其凈水原理_____________________________。
(2)明礬凈水時,若不慎過量會有一定程度的副作用。將含有明礬的水溶液中加入Ba(OH)2溶液至鋁離子恰好完全沉淀,并且過濾,就可以避免,請用離子反方程式描述其過程______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com