
【題目】1,2-二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,密度2.18g·㎝-3,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑。在實驗室中可以用如圖所示制備1,2-二溴乙烷。其中分液漏斗和燒瓶a 中裝有乙醇和濃H2SO4的混合液,試管d 中裝有液溴(表面覆蓋少量水)。

填寫下列空白:
(1)寫出本題中制備1,2-二溴乙烷的兩個化學方程式 , 。
(2)安全瓶b可以防止倒吸,并可以檢查實驗進行時試管d 是否發生堵塞。請寫出發生堵塞時瓶b 中的現象 。
(3)容器c 中NaOH溶液的作用是 。
(4)某學生在做此實驗時,使用一定量的液溴,當溴全部褪色時,所消耗乙醇和濃H2SO4混合液的量,比正常情況超過許多。如果裝置的氣密性沒有問題,試分析其可能的原因_______________。
【答案】(1)CH3CH2OH ![]() CH2=CH2↑+H2O 、CH2=CH2+Br2 → CH2BrCH2Br
CH2=CH2↑+H2O 、CH2=CH2+Br2 → CH2BrCH2Br
(2)b中水面下降,玻璃管中水柱會上升,甚至溢出
(3)除去乙烯中的酸性氣體(SO2、CO2)
(4)①可能溫度控制不當,②乙烯通過液溴速度過快。
【解析】
試題分析:(1)實驗室中用乙醇和濃硫酸加熱來制取乙烯,然后用乙烯和溴單質的加成反應來制得1,2-二溴乙烷,發生反應的化學方程式為CH3CH2OH ![]() CH2=CH2↑+H2O、CH2=CH2+Br2 → CH2BrCH2Br。
CH2=CH2↑+H2O、CH2=CH2+Br2 → CH2BrCH2Br。
(2)根據大氣壓強原理,試管d發生堵塞時,b中壓強的逐漸增大會導致b中水面下降,玻璃管中的水柱上升,甚至溢出,所以答案為b中水面會下降,玻璃管中的水柱會上升,甚至溢出;
(3)氫氧化鈉可以和制取乙烯中產生的雜質氣體二氧化碳和二氧化硫發生反應,防止造成污染,所以NaOH溶液的作用是除去乙烯中帶出的酸性氣體(CO2、SO2);
(4)當溴全部褪色時,所消耗乙醇和濃硫酸混合液的量,比正常情況下超過許多的原因可能是乙烯通過液溴速度過快,導致大部分乙烯沒有和溴發生反應,此外,實驗過程中,乙醇和濃硫酸的混合液沒有迅速達到170℃(溫度控制不當),會導致副反應的發生和副產物的生成。


 優學名師名題系列答案
優學名師名題系列答案科目:高中化學 來源: 題型:
【題目】實驗室用氯酸鉀和二氧化錳制取氧氣的反應方程式為:2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列問題:
(1)該反應中被氧化的元素名稱為 ,生成1mol O2時轉移電子的數目是 。
(2)從反應后的固體混合物中分離出難溶于水的MnO2的具體實驗操作名稱: 。
(3)分離出的MnO2可用于實驗室制取Cl2,化學方程式為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,其離子方程式為 。
MnCl2+Cl2↑+2H2O,其離子方程式為 。
(4)若兩個反應中轉移的電子的物質的量相同,則生成的O2和Cl2在相同狀況下的體積比為 .
(5)以上兩個反應都用到MnO2,其作用分別是 、 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】升高溫度時,化學反應速率加快,主要原因是
A. 分子運動速率加快,使該反應物分子的碰撞機會增多
B. 反應物分子的能量增加,活化分子百分數增大,有效碰撞次數增多
C. 該化學反應的過程是吸熱的
D. 該化學反應的過程是放熱的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2L容器中三種物質的物質的量隨時間的變化曲線如圖所示。由圖中數據分析,該反應的化學方程式和反應開始至2min末Z的平均反應速率分別為 ( )

A. X+3Y=2Z 0.1mol·min—1
B.2X+Y![]() 2Z 0.1mol·min—1
2Z 0.1mol·min—1
C.X+2Y=Z 0.05mol·min—1
D.3X+Y![]() 2Z 0.05mol·min—1
2Z 0.05mol·min—1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】光氣 (COCl2)是一種重要的化工原料,用于農藥、醫藥、聚酯類材料的生產,工業上通過Cl2(g) +CO(g)![]() COCl2(g)制備。左圖為此反應的反應速率隨溫度變化的曲線,右圖為某次模擬實驗研究過程中容器內各物質的濃度隨時間變化的曲線。下列說法不正確的是
COCl2(g)制備。左圖為此反應的反應速率隨溫度變化的曲線,右圖為某次模擬實驗研究過程中容器內各物質的濃度隨時間變化的曲線。下列說法不正確的是
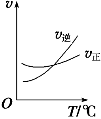
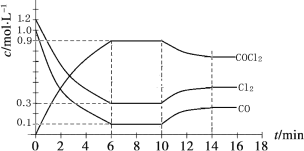
A.0~6 min內,反應的平均速率v(Cl2)=0.15 mol ·L-1·min -1;
B.若保持溫度不變,在第7 min 向體系中加入這三種物質各2 mol,則平衡向正反應方向移動;
C. 隨溫度升高,該反應平衡常數減小;比較第8 min反應溫度T(8)與第15 min反應溫度T(15)的高低:T(8) >T(15)。
D.若將初始投料濃度變為c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反應溫度不變,則最終達到化學平衡時,Cl2的體積分數與上述第6 min時Cl2的體積分數相同;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一支50 mL酸式滴定管中盛有鹽酸,液面恰好在a mL刻度處,把管內液體全部放出,盛量筒內,所得液體體積一定是( )
A. a mL B. (50-a) mL C. 大于(50-a) mL D. 大于a mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】300 mL Al2(SO4)3溶液中,含Al3+為1.62 g,在該溶液中加入0.1 mol·L-1Ba(OH)2溶液100 mL,反應后溶液中SO42-的物質的量濃度約為( )
A.0.4 mol·L-1 B.0.3 mol·L-1 C.0.2 mol·L-1 D.0.1 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2SO2(g)+O2(g)=2SO3(g) △H,有關數據如下:

下列說法不正確的是( )
A.根據平衡常數隨溫度的變化關系,判斷出△H<0
B.保持其他條件不變,SO2的平衡轉化率a(727℃)<a(927℃)
C.增大壓強、降低溫度能提高SO2的轉化率
D.SO3的穩定性隨溫度的升高而降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 需要加熱才能發生的反應一定是吸熱反應
B. 放熱反應在常溫下一定很容易發生
C. 判斷反應是放熱還是吸熱必須看反應物和生成物具有的總能量的相對大小
D. 已知石墨(s)比金剛石(s)穩定,則石墨(s)轉化為金剛石(s)要放出能量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com