
【題目】廢舊鋅錳電池含有鋅、錳元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用廢舊鋅錳電池回收鋅和制備二氧化錳、硫酸的工藝流程如圖:
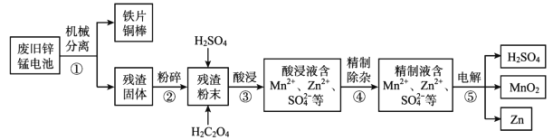
回答下列問題:
(1)步驟②“粉碎”的主要目的是______。
(2)步驟③“酸浸”發生了一系列反應:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推測 Mn2O3 與硫酸反應的離子方程式為______。
(3)如圖分別表示“酸浸”時選用不同濃度硫酸和草酸對 Zn、Mn 浸出率的影響。
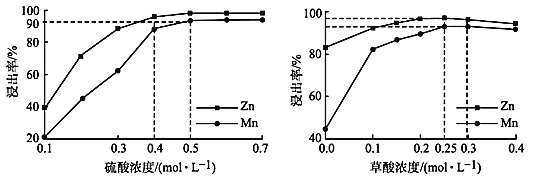
①為保證 Zn、Mn 的浸出率均大于 90%,步驟③需控制的 c(H2SO4) = ____mol/L。H2C2O4 濃度對 Mn 的浸出率影響程度大于 Zn,其原因是_____。
②假設“酸浸”所得溶液中Zn2+、Mn2+濃度相等。當 c(H2C2O4)>0.25 mol/L 時,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序號)。
a.隨著反應進行 c(H+)降低
b.Zn2+、Mn2+與 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步驟⑤用惰性電極電解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 還可能生成 H2、O2 或其混合物。
①生成 MnO2 的電極反應式為_____ 。
②若 n (H2) :n (O2)=2:1,則參加反應的 n (Zn2+):n (Mn2+) = ______。
③該工藝流程中可循環利用的物質是________。
【答案】增大接觸面積,提高浸出率 Mn2O3 +2H+=Mn2++H2O+ MnO2 0.5 Zn元素浸出時不需要還原劑,而+4價Mn (MnO2、Mn2O3、Mn3O4)需加入H2C2O4作還原劑更有利浸出或MnO2+H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O a、b、c Mn2+ +2H2O-2e-=MnO2 +4H+ 1∶1 H2SO4或硫酸
【解析】
將廢舊鋅錳電池機械分離,為增加浸出率,對內部固體殘渣(主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2)粉碎,加入足量H2SO4和草酸對殘渣進行溶浸,發生ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O等一系列反應,得到主要含有Mn2+、Zn2+、SO42-等離子的酸浸液,對酸浸液過濾除雜精制,對含有Mn2+、Zn2+、SO42-等離子的精制液電解得到硫酸、二氧化錳、單質鋅,據此分析解答。
(1)增大接觸面積,提高浸出率;
(2)ZnMn2O4可用氧化物的形式表示ZnO · Mn2O3,ZnO·Mn2O3 +2H2SO4=ZnSO4+ MnSO4+2H2O+ MnO2可知Mn2O3 +2H+=Mn2++H2O+ MnO2;
(3)①由圖可知,當c(H2SO4)=0.5 mol/L時,Mn的浸出率等于90%,Zn的浸出率大于90%。由ZnO+H2SO4=ZnSO4+H2O、MnO+H2SO4=MnSO4+ H2O、ZnMn2O4 + 2H2 SO4=ZnSO4 + MnSO4+2H2O + MnO2、MnO2 + H2SO4 + H2C2O4=MnSO4+2CO2↑+2H2O可知,Zn的浸出只需H2SO4即可,所以Zn元素浸出時不需要還原劑,而+4價Mn(MnO2、Mn2O3、Mn3O4)需加入H2C2O4作還原劑更有利Mn的浸出。或MnO2 + H2SO4+H2C2O4=MnSO4+2CO2↑+2H2O;
②a.結合①的分析,Mn、Zn的浸出率與c(H+ )有關,如果c(H+)減小,浸出率下降,故a正確;
b.c(H2C2O4)>0.25mol/L時,如果Zn2+、Mn2+與C2O![]() 生成沉淀,浸出率下降,故b正確;
生成沉淀,浸出率下降,故b正確;
c.如果溶解度ZnC2O4 <MnC2O4,Zn的浸出率下降先于Mn,故c正確;
答案為:a、b、c;
(4)①根據流程,酸性條件下,Mn2+失去電子轉化為MnO2,則電極反應為:Mn2+ +2H2O-2e-=MnO2 +4H+;
②陰極可能發生的電極反應為Zn2++2e-=Zn,2H++2e-=H2。陽極可能發生的電極反應為Mn2+ +2H2O-2e-=MnO2 +4H+,4OH―― 4e-=2H2O+O2。當n(H2):n(O2)=2:1時電子轉移恰好相等,即電極反應Zn2++2e-=Zn與Mn2+-2e-+2H2O=MnO2 +4H+轉移電子數相等,參加反應的n(Zn2+):n(Mn2+ )=1:1;
③該工藝流程中可循環利用的物質是H2SO4或硫酸。


 課堂練加測系列答案
課堂練加測系列答案 輕松課堂單元測試AB卷系列答案
輕松課堂單元測試AB卷系列答案科目:高中化學 來源: 題型:
【題目】光電池在光照條件下可產生電流,如圖裝置可以實現光能源的充分利用,雙極性膜可將水解離為H+和OH-,并實現其定向通過。下列說法不正確的是( )
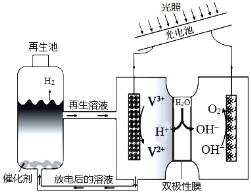
A.該裝置可利用光能實現水的分解
B.光照過程中陰、陽極區溶液中的pH均基本不變
C.再生池中的反應為2V2++2H+![]() 2V3++H2↑
2V3++H2↑
D.每有1molOH-通過雙極性膜,可產生5.6L(標準狀況)的O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向a L密閉容器中加入1 mol X氣體和2 mol Y氣體,發生如下反應:X(g)+2Y(g)![]() 2Z(g),此反應達到平衡的標志是( )
2Z(g),此反應達到平衡的標志是( )
A. 單位時間內消耗0.1 mol X的同時生成0.2 mol Z
B. v正(X) =v逆(Z)
C. 容器內X、Y、Z的濃度之比為1∶2∶2
D. 容器內壓強不隨時間變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰-銅空氣燃料電池容量高、成本低,具有廣闊的發展前景。該電池通過一種復雜的銅腐蝕―現象產生電能,其中放電過程為2Li+Cu2O+H2O=2Cu+2Li++2OH,下列說法錯誤的是
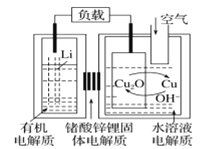
A.放電時,正極的電極反應式為O2+2H2O+4e=4OH
B.放電時,Li+透過固體電解質向右移動
C.通空氣時,銅被腐蝕,表面產生Cu2O
D.整個反應過程中,氧化劑為O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物、碳氧化物和硫氧化物含量顯得尤為重要。
(1)已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol;
②CO的燃燒熱為283.0 kJ/mol。
則2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=________kJ/mol。
(2)在恒溫、恒容條件下,將2.0 mol NO和1.0 mol CO充入一個容積為2 L的密閉容器中發生上述反應,反應過程中部分物質的物質的量(n)變化如圖所示。
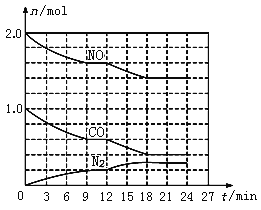
①N2在0~9 min內的平均反應速率v(N2)=________mol/(Lmin);
②第9 min時氮氣的產率為________;
③第12 min時改變的反應條件可能為_______(填字母代號);
A.升高溫度 B.加入NO C.加催化劑 D.減小壓強 E.降低溫度
④若在第24min將NO與N2的濃度同時增加到原來的2倍,化學平衡______移動(填“向正反應方向”、“逆反應方向”或“不”)。
(3)若將反應容器改為恒溫容積可變的恒壓密閉容器,壓強為P=3.0MPa,反應物加入的物質的量不變,達到平衡時CO的轉化率為50%,該溫度下此反應平衡常數Kp=______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列敘述正確的是
A.2.1gDTO中含有的質子數為NA
B.30g葡萄糖和冰醋酸的混合物中含有的氫原子數為4NA
C.12g石墨烯(單層石墨)中含有六元環的個數為2NA
D.1mol鐵在一定條件下分別和氧氣、氯氣、硫完全反應轉移電子數都為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2L密閉容器中充入4molA氣體和3molB氣體,發生下列反應:2A(g)+B(g)![]() C(g)+xD(g),5s達到平衡。達到平衡時,生成了1molC,測定D的濃度為1mol/L。
C(g)+xD(g),5s達到平衡。達到平衡時,生成了1molC,測定D的濃度為1mol/L。
(1)求x=__。
(2)下列敘述能說明上述反應達到平衡狀態的是__。
A.單位時間內每消耗2molA,同時生成1molC
B.單位時間內每生成1molB,同時生成1molC
C.D的體積分數不再變化
D.混合氣體的壓強不再變化
E.B、C的濃度之比為1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①![]() 與
與![]() ;②O2與O3;③正丁烷(CH3CH2 CH2 CH3)與異丁烷
;②O2與O3;③正丁烷(CH3CH2 CH2 CH3)與異丁烷![]() ;④甲烷(CH4)與丙烷(C3H8)。
;④甲烷(CH4)與丙烷(C3H8)。
(1)互為同位素的是______(填序號,下同)。
(2)互為同系物的是______。
(3)互為同分異構體的是______。
(4)互為同素異形體的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環戊二烯( )是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
)是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
對于反應:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某溫度下,等物質的量的碘和環戊烯(![]() )在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
)在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
A.通入惰性氣體 B.提高溫度
C.增加環戊烯濃度 D.增加碘濃度
(3)環戊二烯容易發生聚合生成二聚體,該反應為可逆反應。不同溫度下,溶液中環戊二烯濃度與反應時間的關系如圖所示,下列說法正確的是__________(填標號)。

A.T1>T2
B.a點的反應速率小于c點的反應速率
C.a點的正反應速率大于b點的逆反應速率
D.b點時二聚體的濃度為0.45 mol·L1
(4)環戊二烯可用于制備二茂鐵(Fe(C5H5)2結構簡式為 ),后者廣泛應用于航天、化工等領域中。二茂鐵的電化學制備原理如下圖所示,其中電解液為溶解有溴化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑)。
),后者廣泛應用于航天、化工等領域中。二茂鐵的電化學制備原理如下圖所示,其中電解液為溶解有溴化鈉(電解質)和環戊二烯的DMF溶液(DMF為惰性有機溶劑)。

該電解池的陽極為____________,總反應為__________________。電解制備需要在無水條件下進行,原因為_________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com