
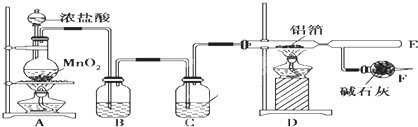
分析 (1)氯化氫易揮發,制取的氯氣中含有氯化氫和水,進入裝置D前應除去,依據氯化氫、濃硫酸的性質選擇合適的試劑;
(2)氯化鋁易升華,生成的氯化鋁氣體會聚集在E處;
(3)根據混合氣體的成分和性質判斷;
(4)氯氣有毒,污染環境,所以不能排空;堿石灰的成分是氧化鈣和氫氧化鈉,氯氣和氧化鈣、氫氧化鈉能反應達到,所以可用堿石灰處理尾氣;空氣中有水蒸氣,堿石灰還能吸收水蒸氣,所以可作干燥劑.
解答 解:(1)濃鹽酸具有揮發性,所以混合氣體中含有氯化氫;氯化氫極易溶于水,氯氣在飽和食鹽水中溶解度不大,可以選擇飽和食鹽水吸收氯化氫,濃硫酸具有吸水性,能夠干燥氯氣;
故答案為:飽和食鹽水,濃硫酸;
(2)氯化鋁在178℃升華,產物以氣體形式存在,主要聚集在C處,故可以在E收集;
故答案為:氯化鋁在178℃升華,產物以氣體形式存在,主要聚集在C處;
(3)因濃鹽酸具有揮發性.反應生成物中有水,在加熱條件下變成水蒸汽,所以混合氣體中的成分是氯化氫、水蒸氣、氯氣;氯化氫和鋁能反應生成氫氣,氫氣和氯氣混合會發生爆炸;
故答案為:未經除去的氯化氫和水蒸氣隨氯氣進入D中和鋁能反應生成氫氣,氫氣和氯氣混合會發生爆炸;(4)氯氣有毒,污染環境,所以不能排空;堿石灰的成分是氧化鈣和氫氧化鈉,氯氣和氧化鈣、氫氧化鈉能反應達到,所以可用堿石灰處理尾氣;空氣中有水蒸氣,堿石灰還能吸收水蒸氣,所以可作干燥劑防止空氣中的水蒸氣進入D中;
故答案為:吸收多余的氯氣,防止污染環境;防止空氣中的水蒸氣進入D中.
點評 本題通過氯化鋁的制取,考查了氯氣的制備和性質的檢驗,熟悉反應原理是解題關鍵,題目難度中等.


 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉的制取:2NaCl(熔融)$\stackrel{通直流電}{→}$2Na+C12↑ | |
| B. | 金屬鎂的制取:MgO+CO$\stackrel{加熱}{→}$Mg+CO2 | |
| C. | 金屬鉻的制取:Cr2O3+2Al$\stackrel{高溫}{→}$2Cr+Al2O3 | |
| D. | 金屬汞的制取:2HgO$\stackrel{加熱}{→}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
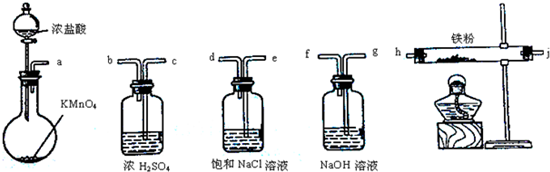
| A. | a-b-c-d-e-e-f-g-h | B. | a-e-d-c-b-h-j-g | ||
| C. | a-d-e-c-b-h-j-g | D. | a-c-b-d-e-h-j-f |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 實驗現象 |
| ①將鎂條用砂紙打磨后,放入試管中,加入少量水后,加熱至水沸騰;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四處游動,發出“嘶嘶”聲,隨之消失,溶液變成紅色. |
| ②向新制得的Na2S溶液中滿加新制的氯水 | B.有氣體產生,溶液變成淺紅色 |
| ③將一小塊金屬鈉放入滴有酚酞溶液的冷水中 | C.劇烈反應,迅速產生大量無色氣體. |
| ④將鎂條投入稀鹽酸中 | D.反應不十分劇烈;產生無色氣體. |
| ⑤將鋁條投入稀鹽酸中 | E.生成白色膠狀沉淀,繼而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至過量 | F.生成淡黃色沉淀. |
| 實驗內容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 實驗現象(填A~F) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 工業上用熱還原法冶煉鐵:Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$3CO2+2Fe | |
| B. | 硫酸工業、合成氨工業和氯堿工業均采用了循環操作提高原料的利用率 | |
| C. | 利用反應:NaCl(飽和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl制取NaHCO3時,應先通入過量的NH3,再通入過量的CO2 | |
| D. | 硫酸生產中常采用高壓條件提高SO2的轉化率 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com