
【題目】鎳與第VA族元素形成的化合物是重要的半導體材料,其中應用最廣泛的是砷化鎵(GaAs)。回答下列問題:
(1)基態N原子的核外電子排布式為___________,基態Ga原子核外有___________個未成對電子。
(2)鎵失去電子的逐級電離能(單位:kJ·mol-1)的數值依次為577、1985、2962、6192,由此可推知鎵的主要化合價為___________和+3。砷的電負性比鎵___________(填“大”或“小”)。
(3)二水合草酸鎵的結構如圖所示,其中鎵原子的配位數為___________。

(4)砷化鎵可由(CH3)3Ga和AsH3在700℃時制得。(CH3)3Ga中鎵原子的雜化方式為___________。
(5)GaAs為原子晶體,密度為ρg·cm-3,其晶胞結構如圖所示。Ga與As以___________鍵鍵合。Ga和As的原子半徑分別為apm和bpm,設阿伏加德羅常數的值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為___________(列出計算式,可不化簡)。

【答案】1s22s22p3 1 +1 大 4 sp2 共價 ![]() ×100%
×100%
【解析】
(1)根據N、Ga的原子序數,結合原子構造原理分析解答;
(2)根據電離能差值分析元素的化合價,電離能差值過大說明失去該電子較困難,同周期元素隨著原子序數增大,電負性增強,同主族元素隨著原子序數增大,電負性增強;根據同一周期元素的電負性變化規律分析比較;
(3)一個Ga與4個O相連,據此判斷配位數;
(4)利用價層電子對互斥模型判斷原子雜化方式;
(5)GaAs為原子晶體,原子間以共價鍵結合;利用均攤法計算一個晶胞中含有的As、Ga原子數,通過計算晶胞體積、晶胞中As、Ga的總體積就可計算出原子的體積占晶胞體積的百分率。
(1)N是7號元素,核外電子排布式是1s22s22p3,Ga是31號元素,位于第四周期第IIIA,核外電子排布式是[Ar]3d104s24p1,應用一個軌道最多可容納2個自旋方向相反的電子,所以在3d、4s軌道上電子成對,只有4p電子是成單電子,故Ga原子核外有1個未成對電子;
(2)根據Ga失去電子的逐級電離能數值,第一電離能和第二電離能差值較大,且第三電離能和第四電離能數值差別較大,說明失去第二個電子和失去第四個電子較困難,所以呈現的價態是+1和+3;Ga、As是同一周期的元素,一般情況下,同一周期的元素,原子序數越大,元素的非金屬性越強,其電負性越大,所有電負性As>Ga;
(3)一個Ga與4個O相連,所以Ga的配位數為4;
(4) (CH3)3Ga中Ga形成3個δ鍵,沒有孤電子對,所有Ga原子的雜化方式為sp2雜化;
(5) GaAs為原子晶體,原子間以共價鍵結合;利用均攤法計算一個晶胞中含有的As、Ga原子數,As:8×![]() +6×
+6×![]() =4,Ga:4×1=4,即一個晶胞中含有4個GaAs;由于晶胞的密度為ρg·cm-3,晶胞的質量m=
=4,Ga:4×1=4,即一個晶胞中含有4個GaAs;由于晶胞的密度為ρg·cm-3,晶胞的質量m=![]() g,所以晶胞的體積V=
g,所以晶胞的體積V=![]() cm3;4個Ga原子的體積為V(Ga)=
cm3;4個Ga原子的體積為V(Ga)=![]() cm3;4個As原子的體積為V(As)=
cm3;4個As原子的體積為V(As)=![]() cm3;所以GaAs晶胞中原子的體積占晶胞體積的百分率為
cm3;所以GaAs晶胞中原子的體積占晶胞體積的百分率為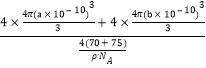 ×100%=
×100%=![]() ×100%。
×100%。


科目:高中化學 來源: 題型:
【題目】研究發現,NOx和SO2是霧霾的主要成分。
Ⅰ. NOx主要來源于汽車尾氣,可以利用化學方法將二者轉化為無毒無害的物質。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=_________,該反應在_______下能自發進行(填寫:高溫或低溫或任意溫度)
2CO2(g)+N2(g) ΔH=_________,該反應在_______下能自發進行(填寫:高溫或低溫或任意溫度)
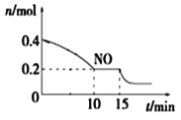
(2)T℃時,將等物質的量的NO和CO充入容積為2 L的密閉容器中,保持溫度和體積不變,反應過程(0~15 min)中NO的物質的量隨時間變化如上圖所示。
①已知:平衡時氣體的分壓=氣體的體積分數×體系的總壓強,T℃時達到平衡,此時體系的總壓強為p=20MPa,則T℃時該反應的壓力平衡常數Kp=_______;平衡后,若保持溫度不變,再向容器中充入NO和CO2各0.3mol,平衡將_____(填“向左”、“向右”或“不”)移動。
②15 min時,若改變外界反應條件,導致n(NO)發生如圖所示的變化,則改變的條件可能是_____(填序號)
A.增大CO濃度 B.升溫 C.減小容器體積 D.加入催化劑
Ⅱ. SO2主要來源于煤的燃燒。燃燒煙氣的脫硫減排是減少大氣中含硫化合物污染的關鍵。

已知:亞硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)請通過計算證明,NaHSO3溶液顯酸性的原因:______________________________
(4)如上方圖示的電解裝置,可將霧霾中的NO、SO2轉化為硫酸銨,從而實現廢氣的回收再利用。通入NO的電極反應式為____________________;若通入的NO體積為4.48L(標況下),則另外一個電極通入的SO2質量至少為________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 風力、化石燃料、太陽能都是一次能源B. 需要加熱才能發生的反應都是吸熱反應
C. 斷開1molC-H鍵要放出一定的能量D. 燃煤發電是將化學能直接轉化為電能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應①:CO(g)+CuO(s) CO2(g)+Cu(s)反應②:H2(g)+CuO(s) Cu(s)+H2O(g),二者在溫度T下的平衡常數分別為K1和K2,該溫度下反應③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常數為K。則下列說法正確的是
A. 反應①的平衡常數K1=c(CO2).c(Cu)/[c(CO).c(CuO)]
B. 反應③的平衡常數K=K1K2。
C. 對于反應③,恒容時,溫度升高,K值減小,則正反應△H<0
D. 對于反應③,恒溫恒容下,增大壓強,H2濃度一定減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉍酸鈉( NaBiO3 )是一種難溶于水的強氧化劑,在鋼鐵工業中常用作錳元素的分析測定。某研究小組用浮選過的輝鉍礦(主要成分是Bi2S3,還含少量Bi2O3,SiO2等雜質)制備鉍酸鈉,其流程如下:

請回答下列問題:
(1)為了提高“浸取”中原料的浸出率,可以采取的措施是_________________(寫一種即可) 。
(2)“浸取”時通常加入FeCl3溶液和濃鹽酸,向其中加入過量濃鹽酸的目的是_____,“濾渣”的成份是____________(填化學式)。
(3)“沉淀”反應的離子方程式為__________________________________________________;
(4)“沉淀”操作時,用氨水調節pH至6,通過計算說明,此時溶液中的Bi3+是否完全沉淀:____________________(已知:Bi(OH)3的溶度積Ksp=3×10-32) 。
(5)“焙燒”除了采用最佳的質量比、合適的溫度外,你認為還需要控制的條件是________。
(6)已知,在酸性溶液中NaBiO3將Mn2+氧化為MnO4-。請出該反應的離子方程式:__________。
(7)某輝鉍礦中鉍元素的質量分數為20.90%,若100噸該輝鉍礦完全用于生產,共得到25.00噸NaBiO3,則產率是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請用如下圖所示儀器設計一個電解飽和食鹽水并測定電解時產生的H2的體積和檢驗Cl2的實驗裝置。(提示:Cl2可與KI反應生成I2,I2遇淀粉變藍)

(1)儀器連接時,各接口的順序是(填字母代號):A接____、__接__;B接__、__接__。
(2)證明產物Cl2的實驗現象是_____________。
(3)實驗測得產生的氫氣體積(已折算成標準狀況)為11.2mL,電解后溶液的體積恰好為50.0mL,則溶液中NaOH的物質的量濃度為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,同溫度下涉及如下反應:
①2NO(g)+Cl2(g)2ClNO(g) 平衡常數為K1;
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) 平衡常數為K2。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K=____(用K1、K2表示)。
(2)若反應①在溫度T下達到平衡時,平衡常數為K1,升高溫度后K1增大,則正反應的焓變△H____0(填“>”、“<”或“=”)。若平衡后在其他條件不變的情況下,充入少量Cl2,Cl2的轉化率___________(填“變大”、“變小”或“不變”,下同),![]() 的值___________。
的值___________。
Ⅱ.近年,科學家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)![]() CH3COOC2H5(g)+2H2(g)在常壓下反應,冷凝收集,測得常溫下液態收集物中主要產物的質量分數如圖3所示。關于該方法,下列推測合理的是________。
CH3COOC2H5(g)+2H2(g)在常壓下反應,冷凝收集,測得常溫下液態收集物中主要產物的質量分數如圖3所示。關于該方法,下列推測合理的是________。

A.反應溫度不宜超過300℃
B.增大體系壓強,有利于提高乙醇平衡轉化率
C.在催化劑作用下,乙醛是反應歷程中的中間產物
D.提高催化劑的活性和選擇性,減少乙醚、乙烯等副產物是工藝的關鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、L、M五種元素的原子序數依次增大。X、Y、Z、L是組成蛋白質的基礎元素,M是地殼中含量最高的金屬元素。
回答下列問題:
(1)L的名稱為__________________________;五種元素的原子半徑從大到小的順序為______________________________(用元素符號表示)。
(2)Z、X兩元素按原子數目比1∶3和2∶4構成分子A和B,工業合成A的化學方程式為______________________________,B的結構式為_____________________。在標準狀況下,將A充滿一個干燥燒瓶,將燒瓶倒置于水中,瓶內液面上升,(假設溶質不擴散)最后燒瓶內溶液中溶質的物質的量濃度為________(精確到0.001)。
(3)硒(Se)是人體必需的微量元素,與L同一主族,Se原子比L原子多兩個電子層,則其最高價氧化物對應水化物的化學式為__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com