
用NA表示阿伏加德羅常數,下列說法中正確的是
A.1 mol甲烷的質量與甲烷的摩爾質量相等
B.28 g氮氣與40 g氬氣所含的原子數目相等,都是NA個
C.2.3 g鈉和過量氧氣反應,失去的電子數為0.1NA
D.18 g重水(D2O)所含的電子數為10NA
 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源:2015-2016學年山西陽泉十五中高三第一次階段考試化學試卷(解析版) 題型:選擇題
用NA表示阿弗加德羅常數,下列說法正確的是
A.0.2 mol H2O2完全分解轉移的電子數為0.4NA
B.300 mL 2 mol·L-1的蔗糖溶液中所含分子數為0.6NA
C.在標準狀況下,2.8g N2和2.8g CO所含電子數均為1.4NA
D.在常溫常壓下,2.24L SO2與O2混合氣體中所含氧原子數為0.2NA
查看答案和解析>>
科目:高中化學 來源:2016屆天津一中高三零月考化學試卷(解析版) 題型:選擇題
相同溫度下,兩種氨水A、B濃度分別為0.2mol/L和0.1mol/L,則A、B的OH-濃度之比
A.大于2 B.小于2 C.等于2 D.不能確定
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西太原五中高二上第一周考理科化學試卷(解析版) 題型:選擇題
下列說法或表示方法正確的是
A.等質量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多
B.由C(金剛石)═C(石墨)△H=-1.9kJ/mol 可知,金剛石比石墨穩定
C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的稀溶液混合,放出的熱量大于57.3 kJ
D.在25 ℃、101 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省衡陽市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
關于鉛蓄電池的說法正確的是
A.在放電時,正極發生的反應是Pb(s)+SO42-(aq)-2e-===PbSO4(s)
B.在放電時,該電池的負極材料是鉛板
C.在充電時,電池中硫酸的濃度不斷變小
D.在充電時,陽極發生的反應是PbSO4(s)+2e-===Pb(s)+SO42-(aq)
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省雙鴨山市高三上第一次月考化學試卷(解析版) 題型:選擇題
將一定質量的鎂、銅合金加入到稀硝酸中,兩者恰好完全反應,假設反應過程中還原產物全是NO,向所得溶液中加入物質的量濃度為3mol/LNaOH溶液至沉淀完全,測得生成沉淀的質量比原合金的質量增加5.1 g,則下列有關敘述中正確的是
A.加入合金的質量可能為9.6g
B.沉淀完全時消耗NaOH溶液體積為150mL
C.參加反應的硝酸的物質的量為0.4mol
D.溶解合金時產生NO氣體體積2.24L
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省雙鴨山市高三上第一次月考化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的數值,下列說法正確的是
A.常溫常壓下,8gO2含有2NA個電子
B.10L 0.1mol·L-1的氨水中有NA個NH4+
C.標準狀況下,22.4L鹽酸含有NA個HCl分子
D.1molNa與足量氧氣反應生成Na2O和Na2O2的混合物,失去NA個電子
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高一9月檢測化學試卷(解析版) 題型:填空題
(1)已知下列反應在一定條件下可以發生:
H 2 O 2 +2Fe 2+ +2H + =2Fe 3+ +2H 2 O H 2 O 2 +2Fe 3+ =2Fe 2+ +O 2 ↑+2H +
(1)在以上反應中Fe 2+ 實際上起著_________作用,總反應式為______________。
(2)I 2 也與Fe 2+ 一樣發生上述類似反應,類比(1)在下面填入配平的合適的化學反應方程式:
H2O2 +I2 =2HIO______________總反應式為_______________。
(3)在H 2 SO 4 和KI的混合溶液中加入足量的H2O2 ,放出大量的無色氣體,溶液呈棕色,并可以使淀粉變藍。有學生認為該反應的離子方程式為:H2O2 +2I-=I2 +O2↑+2H+ ,這個方程式正確嗎?__________。若正確,理由是(若認為不正確,該步不必作答)___________。若不正確,原因是(若認為正確,該步不必作答)__________________,并寫出正確的化學反應方程式為(若是離子反應,寫出離子反應式,沒有離子反應的,寫出化學反應方程式):________________。
查看答案和解析>>
科目:高中化學 來源:2016屆遼寧省高三上學期一模化學試卷(解析版) 題型:實驗題
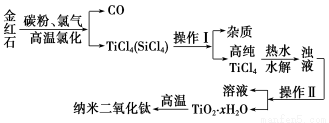
納米材料二氧化鈦(TiO2)具有很高的化學活性,可做性能優良的催化劑。工業上以金紅石(主要成分是TiO2,主要雜質是SiO2)制取納米級二氧化鈦的流程如下:
資料卡片 | ||
物質 | 熔點 | 沸點 |
SiCl4 | -70 ℃ | 57.6 ℃ |
TiCl4 | -25 ℃ | 136.5 ℃ |
(1)寫出氯化時生成TiCl4的化學方程式________________________。
(2)操作Ⅰ、操作Ⅱ名稱分別是______________、____________。
(3)寫出TiCl4水解的化學方程式________________。
(4)如在實驗室中完成灼燒TiO2·xH2O放在________(填字母序號)中加熱。
(5)據報道:“生態馬路”是在鋪設時加入一定量的TiO2,TiO2受太陽光照射后,產生的電子被空氣或水中的氧獲得,生成H2O2。H2O2能清除路面空氣中的CxHy、CO等,其主要是利用了H2O2的________(填“氧化性”或“還原性”)。
(6)某研究小組用下列裝置模擬“生態馬路”的部分原理并測定CO的轉化效率(夾持裝置已略去)。
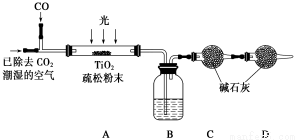
①B裝置中的藥品名稱為________,若通入2.24 L(已折算成標準狀況)CO氣體和足量空氣,最終測得裝置C增重1.1 g,則CO的轉化率為________。
②實驗①中,當CO氣體全部通入后,還要再通一會兒空氣,其目的是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com