
下列為元素周期表中的一部分,用化學式或元素符號回答下列問題:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ⑥ | | ⑦ |  | |
| 三 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 四 | ② | ④ | | | | | ⑨ | |
 三種元素形成的氣態氫化物最穩定的是 。
三種元素形成的氣態氫化物最穩定的是 。 (13分)(1)Ar (2)KOH (3)K+>Ca2+>Mg2+
(4)H2O 2K+2H2O=2K++2OH-+H2↑;Cl2+H2O=H++Cl-+HClO
(5)NaOH HBrO4 NaBr 黃色 Cl2+2Br-=2Cl-+Br2
(6)NaOH+Al(OH)3=NaAlO2+2H2O (7) HF
解析試題分析:根據元素在周期表中的相對位置可知,①~?分別是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar、F。
(1)11種元素中,化學性質最不活潑的是稀有氣體Ar。
(2)金屬性越強,最高價氧化物的水化物的堿性越強。K的金屬性最強,則①②⑤中,最高價氧化物對應的水化物堿性最強的是KOH。
(3)核外電子排布相同的微粒,其微粒半徑隨原子序數的增大而減小,則②③④中形成的簡單離子半徑由大到小的順序是K+>Ca2+>Mg2+。
(4)氧元素的氫化物是H2O,金屬K是活潑的金屬和水反應生成氫氧化鉀和氫氣,反應的離子方程式是2K+2H2O=2K++2OH-+H2↑。氯氣溶于水生成次氯酸和鹽酸,反應的離子方程式是Cl2+H2O=H++Cl-+HClO。
(5)鈉的焰色反應是顯黃色的,由于同主族自上而下非金屬性逐漸減弱,而非金屬性強的可以把弱的置換出來,則氯氣和溴化鈉反應的方程式是Cl2+2Br-=2Cl-+Br2。
(6)氫氧化鋁是兩性氫氧化物,和氫氧化鈉溶液反應的化學方程式是NaOH+Al(OH)3=NaAlO2+2H2O。
(7)非金屬性越強,氫化物的穩定性越強,則⑧⑨?三種元素形成的氣態氫化物最穩定的是HF。
考點:考查元素周期表的結構和元素周期律的應用以及常見化學用語的書寫
點評:該題是高考中的常見題型,屬于中等難度的試題。試題基礎性強,側重對學生基礎知識的鞏固和訓練,有利于提高學生的邏輯推理能力和應試能力。本題主要是元素“位、構、性”三者關系的綜合考查,比較全面考查學生有關元素推斷知識和靈活運用知識的能力,考查了學生對物質結構與性質關系以及運用元素周期律解決具體化學問題的能力。有利于培養學生的邏輯推理能力和發散思維能力以及規范嚴謹的答題能力。


科目:高中化學 來源: 題型:
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ⑤ | |||||
| 3 | ⑥ | ⑦ | ③ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
查看答案和解析>>
科目:高中化學 來源: 題型:
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | =10 ⑩ | |||||||
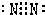
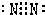
查看答案和解析>>
科目:高中化學 來源: 題型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
| 三 | ① | ③ | ④ | ⑧ | ⑩ | |||
| 四 | ② |  |
 兩元素核電荷之差是
兩元素核電荷之差是查看答案和解析>>
科目:高中化學 來源: 題型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ||||
| 4 | ② | ④ |


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com