
| A. | 催化劑是影響化學反應速率的主要因素 | |
| B. | 化學反應的反應熱與反應途徑無關 | |
| C. | 增大壓強一定能增大化學反應速率 | |
| D. | 反應物分子間發生碰撞即可發生化學反應 |
分析 A、影響化學反應速率的主要因素是反應物本身性質;
B、根據蓋斯定律解答;
C、對于氣相反應,增大壓強化學反應速率會加快;
D、反應物分子的每次碰撞不一定都能發生化學反應.
解答 解:A、影響化學反應速率的主要因素是反應物本身性質,而催化劑是外界條件,故A錯誤;
B、根據蓋斯定律可知,反應熱只與反應體系的始態和終態有關,而與反應的途徑無關,故B正確;
C、只有對于氣相反應,增大壓強化學反應速率會加快,沒有氣體參與的反應,壓強對化學反應速率無影響,故C錯誤;
D、反應物分子的每次碰撞不一定能發生化學反應,只有活化分子的有效碰撞才能發生化學反應,故D錯誤;
故選B.
點評 影響化學反應速率的因素:溫度、濃度、壓強、催化劑,注意各個因素的使用條件是關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 2:71 | B. | 71:2 | C. | 1:8 | D. | 8:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | DMC的結構簡式為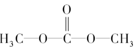 | |
| B. | DMC在空氣不能燃燒 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生產非毒性化工產品,故被譽為有機合成的“綠色化工原料” |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,22.4 L CO2中含有NA個CO2分子 | |
| B. | 1.7 g H2O2中含有的電子數為0.9NA | |
| C. | 標準狀況下,2.24 L乙醇含有的分子數等于0.1NA | |
| D. | 分子數為NA的CO、C2H4混合氣體體積約為22.4 L,質量為28 g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④ | C. | ②⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 制備方法 | 化學共沉淀法 | 碾磨法 | 蒸著(zhuó)法 |
| 制得磁流體顆粒直徑 | 大約40納米左右 | 大于300納米 | 2-10納米 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | MnO4-、Cl-、SO42-、K+ | D. | SiO32-、SO32-、Na+、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com