
分析 (1)加水稀釋促進醋酸電離,加入含有醋酸根離子的物質抑制醋酸電離;
(2)相同條件下加水稀釋醋酸促進醋酸電離;
(3)等pH的醋酸和鹽酸,醋酸的濃度大于鹽酸,中和相同濃度的NaOH溶液時,消耗NaOH溶液體積與酸的物質的量成正比;
(4)pH=2的醋酸濃度大于0.01mol/L,PH=12的NaOH溶液濃度為0.01mol/L,二者等體積混合,醋酸過量,導致溶液呈酸性,再結合電荷守恒判斷;
(5)醋酸是弱電解質,不能完全電離,而HCl是強電解質,能完全電離.
解答 解:(1)醋酸是弱電解質,加水稀釋促進醋酸電離,則電離平衡向向右移動;向醋酸中加入醋酸鈉固體,導致溶液中醋酸根離子濃度增大,抑制醋酸電離,溶液中醋酸分子個數增大,氫離子個數減小,所以溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值減小,
故答案為:向右;減小;
(2)相同條件下,取等體積的甲、乙兩溶液,各稀釋100倍,稀釋過程中,醋酸繼續電離出氫離子,氯化氫完全電離,導致稀釋后的溶液醋酸中氫離子濃度大于鹽酸,所以其pH大小關系為:pH(甲)小于pH(乙),故答案為:小于;
(3)中和相同濃度的NaOH溶液時,消耗NaOH溶液體積與酸的物質的量成正比,等pH的醋酸和鹽酸,醋酸的濃度大于鹽酸,所以等體積等PH的醋酸和鹽酸,醋酸的物質的量大于鹽酸,則醋酸消耗的NaOH體積大于鹽酸,故答案為:大于;
(4)pH=2的醋酸濃度大于0.01mol/L,PH=12的NaOH溶液濃度為0.01mol/L,二者等體積混合,醋酸過量,導致溶液呈酸性,則c(H+)>c(OH-),根據電荷守恒得c(Na+)<c(CH3COO-),故答案為:小于;
(5)醋酸是弱電解質,不能完全電離,而HCl是強電解質,能完全電離,故25mLpH=2的醋酸溶液和pH=2的鹽酸中氫離子的物質的量甲>乙,故加入足量的鋅后,產生氫氣的體積甲大于乙,故答案為:大于.
點評 本題考查了弱電解質的電離,明確弱電解質的電離特點、弱電解質的影響因素等知識點來分析解答,離子濃度大小比較時要明確溶液中的溶質及其性質,再結合電荷守恒來判斷,為易錯點.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:多選題
| A. |  裝置所示裝置可實現反應:Cu+2H2O$\frac{\underline{\;通電\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 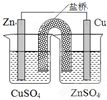 裝置能構成鋅銅原電池 | |
| C. | 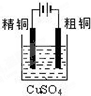 裝置可用于粗銅的電解精煉 | |
| D. |  裝置可用于在實驗室測定中和反應的反應熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
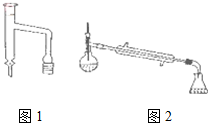 乙酸環己酯具有香蕉及蘋果氣味,主要用于配制各種飲料、冰淇淋等,實驗室制備乙酸環己酯的反應原理、裝置示意圖和有關數據如下:
乙酸環己酯具有香蕉及蘋果氣味,主要用于配制各種飲料、冰淇淋等,實驗室制備乙酸環己酯的反應原理、裝置示意圖和有關數據如下: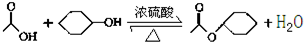
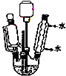 | 相對分子質量 | 密度/g•cm-3 | 沸點 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 環己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸環己酯 | 142 | 0.969 | 173.5 | 難溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉能與硫酸銅稀溶液反應,置換出紅色的銅 | |
| B. | 為了消除碘缺乏病,在食用鹽中必須加入一定量的單質碘 | |
| C. | 過氧化鈉是淡黃色固體,可用作呼吸面具的供氧劑 | |
| D. | 氫氣在氧氣或氯氣中燃燒,都能觀察到淡藍色火焰 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
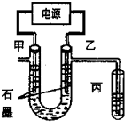 CuCl2溶液中的銅主要以Cu (H2O)42+、CuCl42-形式存在,它們間有如下轉化關系:Cu (H2O)42+ (藍色)+4Cl-?CuCl42- (黃色)+4H2O;電解不同濃度的CuCl2溶液,均可看做Cu2+、Cl-直接放電.下圖為電解濃度較大CuCl2溶液的裝置,實驗開始后,觀察到丙中的KI-淀粉溶液慢慢變藍.回答下列問題:
CuCl2溶液中的銅主要以Cu (H2O)42+、CuCl42-形式存在,它們間有如下轉化關系:Cu (H2O)42+ (藍色)+4Cl-?CuCl42- (黃色)+4H2O;電解不同濃度的CuCl2溶液,均可看做Cu2+、Cl-直接放電.下圖為電解濃度較大CuCl2溶液的裝置,實驗開始后,觀察到丙中的KI-淀粉溶液慢慢變藍.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子式為C3H6O的有機化合物性質相同 | |
| B. | 現在“點石成金”術石墨變成金剛石屬于物理變化 | |
| C. | 過氧化鈉與水反應成1mol氧氣轉移4mol電子 | |
| D. | 工業上冶煉鋁時加入冰晶石的作用是降低氧化鋁的熔融溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
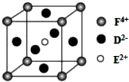 A、B、C、D、E、F是前四周期原子序數依次增大的六種元素.A元素原子的核外電子數等于其電子層數,B元素基態原子有三個能級且各能級電子數相同,A與D可形成兩種常見液態化合物G、H,其原子數之比分別為1:1和2:1,E元素原子的K、L層電子數之和等于其M、N層電子數之和,F被稱為繼鐵、鋁之后的第三金屬,可用于制造飛機、火箭、人造衛星、宇宙飛船等領域.請回答下列各題(涉及元素請用相應化學符號表示):
A、B、C、D、E、F是前四周期原子序數依次增大的六種元素.A元素原子的核外電子數等于其電子層數,B元素基態原子有三個能級且各能級電子數相同,A與D可形成兩種常見液態化合物G、H,其原子數之比分別為1:1和2:1,E元素原子的K、L層電子數之和等于其M、N層電子數之和,F被稱為繼鐵、鋁之后的第三金屬,可用于制造飛機、火箭、人造衛星、宇宙飛船等領域.請回答下列各題(涉及元素請用相應化學符號表示):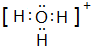 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、K+、H+、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com