
火電廠排放氣體中含有二氧化硫、氮氧化物等大氣污染物,大氣污染物的研究治理對改善環境具有重要意義。
(1)煤燃燒產生的煙氣(含有氮氧化物、SO2、PM2.5等),直接排放到空氣中,引發的主要環境問題有 (填寫字母編號)
A水體富營養化 B重金屬污染 C霧霾 D酸雨
(2)將含有SO2的廢氣通過裝有石灰石漿液的脫硫裝置可以除去其中的二氧化硫,在廢氣脫硫的過程中,所用的石灰石漿液在進入脫硫裝置前,需通一段時間的二氧化碳,以增加其脫硫效率;脫硫時控制漿液的pH值,此時漿液含有的亞硫酸氫鈣可以被氧氣快速氧化生成硫酸鈣。寫出亞硫酸氫鈣被足量氧氣氧化生成硫酸鈣的化學方程式 。
(3)有人提出了一種利用氯堿工業產品治理含二氧化硫廢氣的方法,工藝流程如下:
A的化學式 ,若生成ag A,理論上可以回收SO2的質量為 g。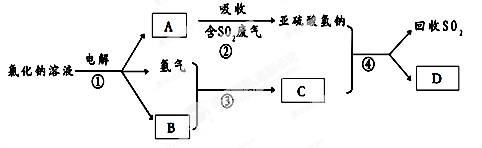
(4)汽車尾氣中含有的氮氧化物(NOx)能形成酸雨,寫出NO2轉化為HNO3的化學方程式 。當尾氣中空氣不足時,NOX在催化轉化器中被還原成N2排出,寫出NO被CO還原的化學方程式 。
(5)工業上常用Na2CO3溶液處理煤燃燒產生的煙氣,寫出SO2、NO與Na2CO3溶液反應生成Na2SO4、N2的離子方程式 。
 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:填空題
許多含氯物質與生活密切相關,如HC10、C102、NaClO2等都是重要的殺菌消毒劑和漂白劑。下列是重要的含氯漂白劑NaClO2的工業合成流程圖。
已知:純ClO2易發生爆炸。請回答下列問題:
(1) 在堿性溶液中NaClO2比較穩定,所以吸收塔中應維持NaOH稍過量,判斷NaOH是否過量的簡單實驗方法是____________。
(2)吸收塔中為防止NaClO2被還原成NaCl,所用還原劑的還原性應適中,除用H2O2外,還可以選擇的還原劑是______(填代號)。
a.Na2O2 b.Na2S c.FeCl2 d.鐵粉
(3)NaClO2溶液與FeCl2溶液相遇,有大量紅褐色沉淀產生,該反應的離子方程式為______
(4)為了測定NaClO2 ? 3H2O的純度,取上述合成產品10 g溶于水配成500 mL溶液,取出10 mL溶液于錐形瓶中,再加人足量酸化的KI溶液,充分反應后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3標準液滴定,錐形瓶中溶液______(填顏色變化),且半分鐘內不發生變化,說明滴定達終點,用去標準液20.OOmL,試樣純度是否合格______(填“合格”或“不合格”,合格純度在90%以上)。提示: 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(13分)直接排放氮氧化物會形成酸雨、霧霾,催化還原法和氧化吸收法師常用的處理方法。
(1)用化學方程式表示NO2形成酸雨的過程____________________________
(2)利用NH3和CH4等氣體除去煙氣中的氮氧化物。
①NH3的電子式
②熱穩定性 NH3 CH4(填“>”=“<”)
③已知:CH4(g)+2O2(g)=CO2(g)+2H20(l) △H1=akJ/mol; 欲計算反應CH4(g)+4NO(g)=CO2(g)+2H20(l)+2N2(g)的焓變 △H2則還需要查詢某反應的焓變△H3,當反應中各物質的化學計量數之比為最簡整數比時,△H3=bkJ/mol,該反應的熱化學方程式是__________________________據此計算出△H2= kJ/mol (用含a、b的式子表示)。
(3)利用氧化法除去煙氣中的氮氧化物。首先向氮氧化物中補充氧氣,然后將混合氣體通入石灰乳中,使之轉化為硝酸鈣。已知某氮氧化物由NO和NO2組成,且n(NO):n(NO2)=1:3.寫出氧化吸收法除去氮氧化物的化學方程式______________________________________現有標況下的O233.6ml,理論上可以處理該氮氧化物______ml(標準狀況下)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硅是帶來人類文明的重要元素之一,從傳統材料到信息材料的發展過程中創造了一個又一個奇跡。
(1)硅在元素周期表中的位置是_______。
(2)工業生產粗硅的反應有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若產品中單質硅與碳化硅的物質的量之比為1:1,則參加反應的C和SiO2的質量之比為 。
SiC+2CO↑。若產品中單質硅與碳化硅的物質的量之比為1:1,則參加反應的C和SiO2的質量之比為 。
(3)工業上可以通過如下圖所示的流程制取純硅: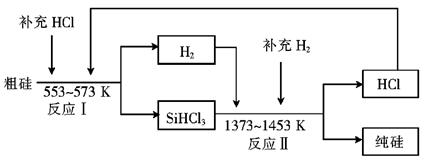
①若反應I為 Si(粗)+3HCl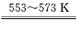 SiHCl3+H2,
SiHCl3+H2,
則反應II的化學方程式為 。
②整個制備過程必須嚴格控制無水無氧。SiHCl3遇水劇烈反應生成H2SiO3、HCl和另 一種物質,寫出該反應的化學方程式: 。
③假設每一輪次制備1mol純硅,且生產過程中硅元素沒有損失,反應I中HCl的利用率為90%,反應II中H2的利用率為93.75%,則在第二輪次的生產中,補充投入HCl 和H2的物質的量之比是 。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(15分)
某學習小組依據SO2具有還原性,推測SO2能被Cl2氧化生成SO2Cl2。
查閱資料:SO2Cl2常溫下為無色液體,極易水解,遇潮濕空氣會產生白霧。
Ⅰ.化合物SO2Cl2中S元素的化合價是 。
Ⅱ.用二氧化錳和濃鹽酸制氯氣的化學方程式是 。
Ⅲ.在收集氯氣前,應依次通過盛有飽和食鹽水和 的洗氣瓶。
Ⅳ.用如圖所示裝置收集滿Cl2,再通入SO2,集氣瓶中立即產生無色液體,
充分反應后,將液體和剩余氣體分離,進行如下研究。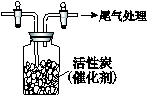
(1)研究反應的產物。向所得液體中加水,出現白霧,振蕩、靜置得到無色溶液。經檢驗該溶液中的陰離子(除OH-外)只有SO42-、Cl- ,證明無色液體是SO2Cl2。
① 寫出SO2Cl2與H2O反應的化學方程式 。
② 檢驗該溶液中Cl-的方法是 。
(2)繼續研究反應進行的程度。用NaOH溶液吸收分離出的氣體,用稀鹽酸酸化后,再滴加BaCl2溶液,產生白色沉淀。
① 該白色沉淀的成分是 。
② 寫出SO2與Cl2反應的化學方程式,并闡述理由______。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
圖①-?分別代表有關反應中的一種物質,請填下以下空白。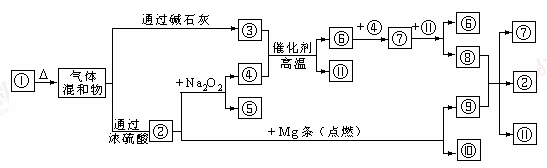
(1)①、④的化學式分別是______、______。
(2)用電子式表示②的形成過程為 ;
(3)⑧與⑨反應的化學方程式是______;檢驗③的存在的方法是 。
(4)Mg也可以與⑧的稀溶液反應生成⑥,寫出反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某校化學小組為探究鐵與濃硫酸反應是否生成SO2,設計了以下裝置進行實驗。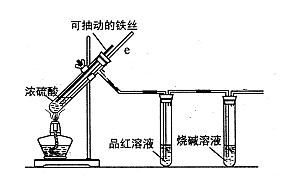
(1)寫出鐵與濃硫酸反應的化學方程式 ;
若在取用濃硫酸的過程中,不慎在皮膚上沾少量濃硫酸,處理的方法是 。
(2)導氣管e有兩個主要作用:一是在反應過程中,因導管插入液面下,可起到“液封”作用阻止SO2氣體逸出而防止污染環境;二是 。
(3)品紅溶液的作用是 。
(4)小組討論后認為:由于常用的鐵絲是鐵碳合金,生成的氣體中還可能含有CO2。寫出生成CO2的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某校化學興趣小組設計了圖示實驗裝置(圖中省略了夾持儀器)來測定某鐵碳合金中鐵的質量分數,并探究鐵與濃硫酸的反應。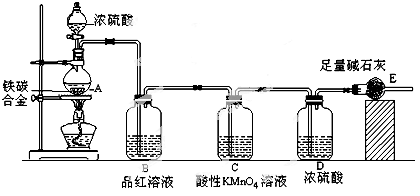
(1)m克鐵碳合金中加入過量濃硫酸,未點燃酒精燈前,A、B均無明顯現象,其原因是①常溫下碳與濃硫酸不反應;② 。
(2)寫出加熱時A中碳與濃硫酸發生反應的化學方程式 。
(3)B中的現象是 ;C的作用是 。
(4)隨著反應的進行,A中還可能發生某些離子反應,寫出相應的離子方程式
反應一段時間后,從A中逸出氣體的速率仍然較快,除因溫度較高,反應放熱外,還可能的原因是 ;
(5)待A中不再逸出氣體時,停止加熱,拆下E并稱重,E增重bg。則鐵碳合金中鐵的質量分數為 (寫含m、b的表達式)。
(6)某同學認為上述方法較復雜,使用下圖所示的裝置和其它常用實驗儀器測定某些數據即可。為了快速和準確的計算出鐵的質量分數,最簡便的實驗操作是 (填寫代號)。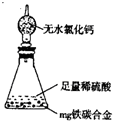
A.用排水法測定H2的體積
B.反應結束后,過濾、洗滌、稱量殘渣的質量
C.測定反應前后裝置和藥品的總質量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com