
【題目】吲哚昔酚 (idoxifene)可用于治療骨質疏松癥,它的合成路線如 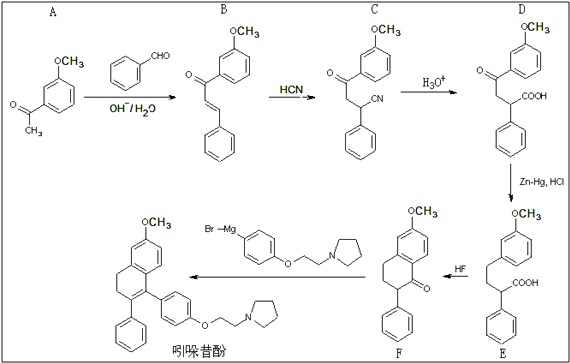
(1)反應類型:B→C;D→E
(2)D中的含氧官能團為(寫名稱)
(3)滿足下列四個條件的A的同分異構體數目有種. ①苯的衍生物,且苯環上只有兩個互為對位的取代基;②能發生銀鏡反應;③與FeCl3溶液作用不顯色;④不與氫氧化鈉水溶液反應
(4)E→F中還有一種副產物G生成,G與F互為同分異構體,且含有三個六元環,G結構簡式為
(5)2,2﹣二甲基戊酸[CH3CH2CH2C(CH3)2COOH]是有機合成中間體,請設計合理的方案以丙酮(CH3COCH3)為唯一有機原料合成2,2﹣二甲基戊酸異丙酯(用合成路線流程圖表示,并注明反應條件) 提示:①合成過程中無機試劑任選;②丙酮分子間能發生如圖合成路線中A→B的類似反應;③合成路線流程圖示例:CH3CH2OH ![]() CH2═CH2
CH2═CH2 ![]() CH2Br﹣CH2Br.
CH2Br﹣CH2Br.
【答案】
(1)加成反應;還原反應
(2)羧基、羰基、醚鍵
(3)8
(4)![]()
(5)
【解析】解:(1)對比B、C的結構可知,B與HCN發生加成反應得到C,對比D、E的結構,可知D失去羰基中O原子被2個H原子代替,屬于還原反應,
所以答案是:加成反應;還原反應;(2)根據D的結構可知,含有的含氧官能團有:羧基、羰基、醚鍵,
所以答案是:羧基、羰基、醚鍵;(3)A的同分異構體滿足:①苯的衍生物,且苯環上只有兩個互為對位的取代基;②能發生銀鏡反應,含有醛基;③與FeCl3溶液作用不顯色,沒有酚羥基,④不與氫氧化鈉水溶液反應,說明沒有酯基等,結合A的結構可知,含有醇羥基,若其中一個側鏈為﹣CHO,另外側鏈為﹣CH2CH2OH或﹣CH(CH3)OH或﹣OCH2CH3或﹣CH2OCH3,若其中一個側鏈為﹣CH2CHO,另外側鏈為﹣OCH3或﹣CH2OH,可以是一個側鏈為甲基、另外側鏈為﹣CH(OH)CHO或﹣OCH2CHO,故符合條件的同分異構體共有8種,
所以答案是:8;(4)對比E、F的結構,可知E中羧基提供﹣OH、苯環提供H原子,脫去1分子水生成F,G與F互為同分異構體,且含有三個六元環,則副產物G的結構簡式為: ![]() ,
,
所以答案是: ![]() ;(5)利用轉化關系中A→F的系列轉化可知,丙酮在堿性條件下得到CH3COCH=C(CH3)2,CH3COCH=C(CH3)2與HCN發生加成反應得到CH3COCH2C(CH3)2CN,再在酸性條件下水解得到CH3COCH2C(CH3)2COOH,最后在Zn﹣Hg/HCl條件下得到CH3CH2CH2C(CH3)2COOH,丙酮與氫氣發生加成反應生成異丙醇,CH3CH2CH2C(CH3)2COOH與異丙醇發生酯化反應得目標物,合成路線流程圖為:
;(5)利用轉化關系中A→F的系列轉化可知,丙酮在堿性條件下得到CH3COCH=C(CH3)2,CH3COCH=C(CH3)2與HCN發生加成反應得到CH3COCH2C(CH3)2CN,再在酸性條件下水解得到CH3COCH2C(CH3)2COOH,最后在Zn﹣Hg/HCl條件下得到CH3CH2CH2C(CH3)2COOH,丙酮與氫氣發生加成反應生成異丙醇,CH3CH2CH2C(CH3)2COOH與異丙醇發生酯化反應得目標物,合成路線流程圖為:  ,
,
所以答案是:  .
.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】用如圖所示的裝置進行電解.通電一會兒,發現用NaCl溶液濕潤的淀粉KI試紙的C端變為藍色. 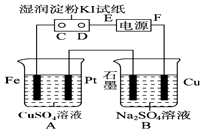
(1)E為電源的極,Fe為極.
(2)A中發生反應的離子方程式為 , B中發生反應的化學方程式為 .
(3)在B中觀察到的現象是
(4)若此電源為鉛蓄電池,電池總反應式為: Pb+PbO2+4H++2SO42﹣ ![]() PbSO4+2H2O
PbSO4+2H2O
則放電時:正極的電極反應式是;充電時:陰極的電極反應式是;當外電路通過1mol電子時,理論上負極板的質量增加g,此時若要使A池中的溶液復原,應加入g的CuO固體.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,正確的是( )
A.Mg的摩爾質量是24g/mol
B.22gCO2物質的量為2.2mol
C.1molCl2中含有的氯原子數約為6.02×1023
D.常溫常壓下,1molN2的體積是22.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年IUPAC命名117號元素為TS(中文名![]() ,tián),TS的原子核外最外層電子數是7.下列說法不正確的是( )
,tián),TS的原子核外最外層電子數是7.下列說法不正確的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的電子數
C. TS在同族元素中非金屬性最弱 D. 中子數為176的TS核素符號是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A(g)+3B(g) =2C(g)+2D(g)在四種不同情況下的反應速率分別為:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,該反應進行的快慢順序為
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在盛有碘水的試管中,加入少量CCl4后振蕩,靜置片刻后( )
A.整個溶液變紫色
B.整溶液變為棕黃色
C.上層為無色下層為紫紅色
D.下層無色上層紫紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組以鐵為陽極,探究不同條件下陽極發生的電極反應。
實驗裝置 | 實驗 | 電壓 | 電解液 | 實驗現象 |
| ⅰ | 3V | 3mol/LNa2SO4溶液 | 碳棒表面有大量氣泡產生,溶液變黃,有紅褐色沉淀產生 |
ⅱ | 3V | 3 mol/L KI溶液 | 碳棒表面有大量氣泡產生,鐵絲附近溶液變為棕色,逐漸變為棕褐色,約5min后,棕褐色消失,逐漸產生灰綠色絮狀物 | |
ⅲ | 3V | 3mol/L NaOH溶液 | 兩電極上都有大量氣泡產生,5min后停止實驗,取出鐵絲,鐵絲明顯受腐,附有紅棕色固體,溶液中未見沉淀物。 |
(1)①實驗ⅰ中碳棒表面產生的氣體是__________。
②實驗ⅲ中鐵絲上生成氣體的電極反應式為__________。
③在實驗ⅱ中,為驗證鐵絲電極的產物,取少量鐵絲附近棕色溶液于試管中,滴加2滴K3Fe(CN)6溶液,無明顯變化;另取少量鐵絲附近棕色溶液檢驗發現溶液中有I2,檢驗方法是__________;對比實驗ⅰ、ⅱ、ⅲ,可得出的結論是__________。
(2)為進一步探究增大c(OH-)對陽極反應的影響,該小組利用原裝置做了實驗ⅳ。
實驗 | 電壓 | 電解液 | 實驗現象 |
ⅳ | 3V | 10 mol/L NaOH溶液 | 兩電極上都有大量氣泡產生,但碳棒上的速率遠大于鐵絲,且陽極區溶液逐漸變紫紅色;停止實驗,鐵絲明顯變細,電解液仍然澄清 |
查閱資料:FeO42-在溶液中呈紫紅色。陽極電極反應式是__________。
(3)為探究實驗ⅰ中溶液變黃的原因,該小組利用原裝置做了實驗ⅴ和ⅵ。
實驗 | 電壓 | 電解液 | 實驗現象 |
ⅴ | 3V | 煮沸冷卻的3 mol/L Na2SO4溶液 | 碳棒表面有大量氣泡產生,鐵絲外圍包裹一層白色絮狀沉淀,2min后表層變為褐色。 |
ⅵ | 8V | 煮沸冷卻的3 mol/L Na2SO4溶液 | 碳棒表面迅速產生大量氣泡,鐵絲表面有氣泡,1min后外圍包裹一層白色絮狀沉淀,2min后變綠,溶液中有紅褐色懸浮物。 |
①實驗ⅵ中白色絮狀沉淀變為紅褐色的反應化學方程式是__________。
②由此確定實驗ⅰ中溶液變黃的原因是__________。
(4)綜合上述實驗,當鐵為陽極時,影響電解過程中的陽極電極產物的因素有__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X2+的核外電子排布式為1s22s22p6,下列說法正確的是( )
A. X可能為稀有元素 B. X原子的核外電子排布為1s22s22p63s2
C. X原子的核外電子排布為1s22s22p62d2 D. X2+的最外電子層上有6個電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com