
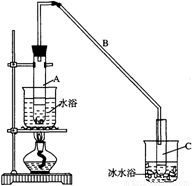
某化學小組采用類似制乙酸乙酯的裝置(如圖),以環己醇制備環己烯:
已知: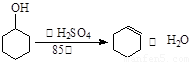
|
|
密度 (g/cm3) |
熔點 (℃) |
沸點 (℃) |
溶解性 |
|
環己醇 |
0.96 |
25 |
161 |
能溶于水 |
|
環己烯 |
0.81 |
-103 |
83 |
難溶于水 |
(1)制備粗品
將12.5mL環己醇加入試管A中,再加入1mL濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
①A中碎瓷片的作用是 ,導管B除了導氣外還具有的作用是 。
②試管C置于冰水浴中的目的是 。
(2)制備精品
①環己烯粗品中含有環己醇和少量酸性雜質等。加入飽和食鹽水,振蕩、靜置、分層,環己烯在 層(填“上”或“下”),分液后用 (填入編號)洗滌。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再將環己烯按圖裝置蒸餾,冷卻水從 口進入。蒸餾時要加入生石灰,目的是: 。
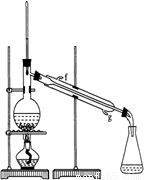
③收集產品時,控制的溫度應在 左右,實驗制得的環己烯精品質量低于理論產量,可能的原因是 _______
A.蒸餾時從70℃開始收集產品 B.環己醇實際用量多了
C.制備粗品時環己醇隨產品一起蒸出
(3)以下區分環己烯精品和粗品的方法,合理的是_______
A.用酸性高錳酸鉀溶液 B.用金屬鈉 C.測定沸點
(4)由環己烯再轉化為環己醇的化學方程式為:______________
(1) ① 防止暴沸; 冷凝。 ②防止環己烯的揮發。
(2) ①上; C。 ②g;除去水分。 ③ 83℃ ; C。
(3)B、C。
(4)環己烯 + H2O——環己醇
【解析】
試題分析:(1)①加熱液體時,為了防止液體爆沸,常采用加入沸石或碎瓷片;易揮發的物質反應時為提高其利用率,一般要有冷凝回流裝置,導管B即是起到這種作用;②反應生成的產物沸點較高,易揮發,應采用冰水冷卻,防止環己烯的揮發;(2)①烴的密度比水小,與水混合時,環己烯在上層;要除去產品中的酸雜質,可用碳酸鈉等堿性溶液除去;②實驗中一般采用逆流冷卻,蒸餾時加入生石灰目的是與水反應,防止與產品一起蒸餾出;③收集產品時,控制的溫度應讓環己烯揮發出來,而2環己醇等留在溶液中,理論溫度可控制在83℃——161℃,又因為是水浴加熱和能量的消耗等方面可控制溫度低一些 83℃即可;實驗制得的環己烯精品質量低于理論產量,說明環己烯或環己醇損失了,故答案為C;(3)粗品中含有環己醇能與鈉反應,且混合物沸點不固定,與環己烯沸點不同。
考點:考查物質制備實驗中操作、目的、原理、誤差分析等有關問題。


科目:高中化學 來源: 題型:


| 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | 環己醇 | 0.96 | 25 | 161 | 能溶于水 | 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解


| 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | 環己醇 | 0.96 | 25 | 161 | 能溶于水 | 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:
某化學小組采用類似制乙酸乙酯的裝置(如圖Ⅰ)以環己醇制備環己烯。

已知:
| 密度(g·cm-3) | 熔點(℃)沸 | 點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |

圖Ⅰ
(1)制備粗品
將12.5 mL環己醇加入試管A中,再加入1 mL濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
①A中碎瓷片的作用是_____________,導管B除了導氣外還具有的作用是_______________。
②試管C置于冰水浴中的目的是_________________________________________________。
(2)制備精品
①環己烯粗品中含有環己醇和少量酸性雜質等。中和飽和食鹽水,振蕩、靜置、分層,環己烯在_______________層(填“上”或“下”),分液后用_______________(填入編號)洗滌。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液

圖Ⅱ
②再將環己烯按圖Ⅱ裝置蒸餾,冷卻水從____________口進入。蒸餾時要加入生石灰,目的是____________。
③收集產品時,控制的溫度應在____________左右,實驗制得的環己烯精品質量低于理論產量,可能的原因是________________________。
a.蒸餾時從70 ℃開始收集產品
b.環己醇實際用量多了
c.制備粗品時環己醇隨產品一起蒸出
(3)以下區分環己烯精品和粗品的方法,合理的是____________。
a.用高錳酸鉀酸性溶液 b.用金屬鈉 c.測定沸點
查看答案和解析>>
科目:高中化學 來源:2011-2012學年河北省唐山一中高二下學期期中考試化學試卷(帶解析) 題型:實驗題
(11分)某化學小組采用類似制乙酸乙酯的裝置(如圖),以環己醇制備環己烯。
已知:

| | 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 |
| 環已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環已烯 | 0.81 | -103 | 83 | 難溶于水 |

查看答案和解析>>
科目:高中化學 來源:2011-2012學年廣東省梅州市曾憲梓中學高二5月月考化學試卷(帶解析) 題型:實驗題
(20分)某化學小組采用類似制乙酸乙酯的裝置(如圖),以環己醇制備環己烯
(1)制備粗品
將12.5mL環己醇加入試管A中,再加入lmL濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
①A中碎瓷片的作用是____________,導管B除了導氣外還具有的作用是____ 。
②試管C置于冰水浴中的目的是_____________________________。
(2)制備精品
①環己烯粗品中含有環己醇和少量酸性雜質等。加入飽和食鹽水,振蕩、靜置、分層,環己烯在______層(填上或下),分液后用_________ (填入編號)洗滌。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再將環己烯按下圖裝置蒸餾,冷卻水從_________口進入。蒸餾時要加入生石灰,目的是______________ ____。
③收集產品時,控制的溫度應在_________左右,實驗制得的環己烯精品質量低于理論產量,可能的原因是____________________
A.蒸餾時從70℃開始收集產品
B.環己醇實際用量多了
C.制備粗品時環己醇隨產品一起蒸出
(3)以下區分環己烯精品和粗品的方法,合理的是_________。
A.用酸性高錳酸鉀溶液 B.用金屬鈉 C.測定沸點
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com