
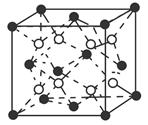
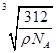
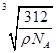 。
。

科目:高中化學 來源:不詳 題型:填空題


查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
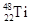 和
和 兩種原子,它們互稱為 ,鈦基態原子的電子排布式為 ;
兩種原子,它們互稱為 ,鈦基態原子的電子排布式為 ;
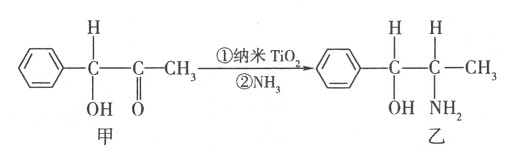
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.14N與15N為同種核素 |
| B.14N的第一電離能小于14C |
| C.15NH3與14NH3均能形成分子間氫鍵 |
| D.CH315NH2與CH3CH214NH2互為同系物 |
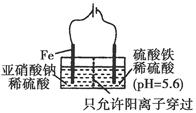
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
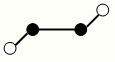

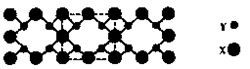
| A.該晶體屬于分子晶體 |
| B.此晶體的硬度比金剛石還大 |
| C.晶體的化學式是X3Y4 |
| D.晶體熔化時破壞共價鍵 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com