
【題目】電子構型為[Ar]3d54s2的元素是
A. 稀有氣體 B. 過渡元素 C. 主族元素 D. 鹵族元素
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列有關氟氯烴的說法中不正確的是
A. 氟氯烴是一類含氟和氯的鹵代烴
B. 氟氯烴的化學性質穩定,有毒
C. 氟氯烴大多無色、無臭、無毒
D. 在平流層中,氟氯烴在紫外線照射下分解產生的氯原子可引發損耗臭氧的循環反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從煤和石油中可以提煉出化工原料A和B,A是一種果實催熟劑,它的產量用來衡量一個國家的石油化工發展水平。B是一種比水輕的油狀液體,B僅由碳氫兩種元素組成,碳元素與氫元素的質量比為12:1,B的相對分子質量為78。回答下列問題:
(1)A的電子式_______,B的結構簡式_____________________。
(2)與A相鄰的同系物C使溴的四氯化碳溶液褪色的化學反應方程式:___________________。
(3)在碘水中加入B振蕩靜置后的現象________________。
(4)B與濃硫酸和濃硝酸在50~60℃反應的化學反應方程式:_____________________________,反應類型:________。
(5)等質量的A、B完全燃燒時消耗O2的物質的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,通過下列反應可以制備特種陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g)ΔH>0。該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是
MgO(s)+CO2(g)+SO2(g)ΔH>0。該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是
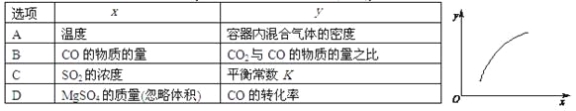
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學按照下面的實驗方法制備氫氧化鐵膠體:首先取少量蒸餾水于潔凈的燒杯中,用酒精燈加熱至沸騰,向燒杯中逐滴滴加飽和的FeCl3溶液繼續煮沸,至液體呈透明的紅褐色。反應原理為FeCl3+3H2O![]() Fe(OH)3(膠體)+3HCl。
Fe(OH)3(膠體)+3HCl。
(1)判斷膠體制備是否成功,可利用膠體的________。
(2)在做制備氫氧化鐵膠體的實驗時,有些同學沒有按要求進行,結果沒有觀察到膠體,請你預測其現象并分析原因:
①甲同學沒有選用飽和氯化鐵溶液,而是將稀氯化鐵溶液滴入沸水中,結果沒有觀察到_________________________________,其原因是_________________________________________。
②乙同學在實驗中沒有使用蒸餾水,而是用自來水,結果會________,原因是____________________________________________________________________。
③丙同學向沸水中滴加飽和氯化鐵溶液后,長時間加熱,結果會________,原因是_____________________________________________________________________。
(3)丁同學按要求制備了Fe(OH)3膠體,但是他又向Fe(OH)3膠體中逐滴加入了稀H2SO4溶液,結果出現了一系列變化。
①先出現紅褐色沉淀,原因是_________________________________________。
②隨后沉淀溶解,此反應的離子方程式是_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置可用于收集SO2并驗證其某些化學性質,下列說法正確的是( )

選項 | 試劑 | 現象 | 結論 |
A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
B | 品紅溶液 | 溶液褪色 | SO2有漂白性 |
C | 滴有酚酞的NaOH溶液 | 溶液褪色 | SO2有漂白性 |
D | 硫化氫水溶液 | 溶液變渾濁 | SO2有還原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2 molX和2molY充入2L密閉容器中發生如下反應:X(氣)+3Y(氣)![]() 2Z(氣)+aQ(氣)2min達到平衡時生成0.8molZ,測得Q的濃度為0.4mol/L,下列敘述錯誤的是( )
2Z(氣)+aQ(氣)2min達到平衡時生成0.8molZ,測得Q的濃度為0.4mol/L,下列敘述錯誤的是( )
A.a的值為2
B.平衡時X的濃度為0.8mol/L
C.Y的轉化率為60%
D.反應速率v(Y)=0.6mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】活性氧化鋅用作橡膠硫化的活性劑、補強劑。以氧化鋅粗品為原料制備活性氧化鋅的生產工藝流程如下:

一些陽離子以氫氧化物形式完全沉淀時溶液的pH見下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
pH | 3.2 | 6.7 | 8.0 | 9.7 |
(1)“溶解”前將氧化鋅粗品粉碎成細顆粒,目的是_____________________________。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等雜質。先加入___________(填“Na2CO3”或“H2SO4”)調節溶液的pH至5.4,然后加入適量KMnO4,Fe2+轉化為Fe(OH)3,同時KMnO4轉化為MnO2,,經檢測溶液中Fe2+的濃度為0.009mol·L-1,則每升溶液中至少應加入__________mol KMnO4。
(3)雜質Cu2+可利用置換反應除去,應選擇的試劑是___________。
(4)“沉淀”后所得“濾渣”的成分為ZnCO3·2Zn(OH)2·H2O,其在450~500℃下進行“煅燒”,“煅燒”反應的化學方程式為____________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com