
【題目】已知X、Y、Z三種元素均為短周期元素,原子序數依次遞增,Q、W為前30號元素。5種元素的部分特點:

(1)XF3分子中X的雜化類型為______,該分子的空間構型為_______.
(2)基態Q原子的電子排布式為_____________________,第一電離能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z電負性由大到小的順序為____________(用元素符號表示).
(4)Na在Y2中燃燒產物的電子式為________________.
(5)Z和X形成的化合物常用作高溫耐火材料,化學性質穩定,據此推測它應屬于_______晶體.
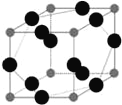
(6)W元素與X元素形成某種化合物的晶胞結構如圖所示(黑球代表W原子),若該晶體的密度為ρ g·cm-3,則該晶胞的體積是__________cm3.
【答案】 sp3 三角錐形 1s22s22p63s23p63d24s2 > O>N>Si ![]() 原子 206/(NA.ρ)
原子 206/(NA.ρ)
【解析】本題考查位置結構性質的相互關系。(1)X的氣態氫化物呈三角錐形,水溶液顯堿性,X為N,NF3分子中價層電子對個數=σ鍵個數+孤電子對個數=3+![]() =4,所以NF3分子中N的雜化類型為sp3,該分子的空間構型為三角錐形;(2)Q被譽為“太空金屬”,也有“生物金屬”之稱,Q為22號元素鈦(Ti),基態原子的電子排布式為:1s22s22p63s23p63d24s2;Y的最外層電子數等于次外層電子數的3倍,且基態原子核外由3個能級,故Y為O,元素N、O屬于同一周期元素且原子序數依次增大,同一周期元素的第一電離能隨著原子序數的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一電離能大小順序是X(N)>Y(O);(3)Z元素原子的外圍電子為nsn-1npn-1,s能級最多排列2個電子,所以n=3,則Z是Si元素,非金屬性越強電負性越大可知X(N)、Y(O)、Z(Si)的電負性由大到小的順序為:O>N>Si; (4)Na在Y2(O2)中燃燒產物位Na2O2,其電子式為
=4,所以NF3分子中N的雜化類型為sp3,該分子的空間構型為三角錐形;(2)Q被譽為“太空金屬”,也有“生物金屬”之稱,Q為22號元素鈦(Ti),基態原子的電子排布式為:1s22s22p63s23p63d24s2;Y的最外層電子數等于次外層電子數的3倍,且基態原子核外由3個能級,故Y為O,元素N、O屬于同一周期元素且原子序數依次增大,同一周期元素的第一電離能隨著原子序數的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一電離能大小順序是X(N)>Y(O);(3)Z元素原子的外圍電子為nsn-1npn-1,s能級最多排列2個電子,所以n=3,則Z是Si元素,非金屬性越強電負性越大可知X(N)、Y(O)、Z(Si)的電負性由大到小的順序為:O>N>Si; (4)Na在Y2(O2)中燃燒產物位Na2O2,其電子式為![]() ;(5)硅和氮形成的化合物氮化硅,由于熔點高,化學性質穩定,所以氮化硅為原子晶體;(6)W為Cu,X為N,該晶胞中,Cu原子個數為12×
;(5)硅和氮形成的化合物氮化硅,由于熔點高,化學性質穩定,所以氮化硅為原子晶體;(6)W為Cu,X為N,該晶胞中,Cu原子個數為12×![]() =3,N原子個數為8×
=3,N原子個數為8×![]() =1,該晶胞的化學式為Cu3N,該晶胞的體積為
=1,該晶胞的化學式為Cu3N,該晶胞的體積為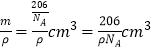 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】制備乙酸乙酯的綠色合成路線之一為:

下列說法不正確的是
A. M的分子式為C6H12O6 B. N的結構簡式為CH3COOH
C. ④的反應類型屬于取代反應 D. 淀粉與纖維素互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是( )
A. 溴水中當加入硝酸銀溶液后,溶液顏色變淺 B. 高壓比常壓有利于工業合成氨反應
C. 紅棕色NO2加壓后顏色比原來要深 D. 熱的純堿除油污效果好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由CO2、H2和CO組成的混合氣體在同溫同壓下與氮氣的密度相同。則該混合氣體中CO2、H2和CO的體積比為
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用正確的化學用語表達
(1)寫出N2的結構式:____。
(2)寫出1,2-二溴乙烷的結構簡式:____。
(3)寫出銅與氯化鐵溶液反應的離子方程式: ____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外興趣小組通過實驗發現鉀和鈉的性質相似,下列說法中能最好地解釋這個事實的是( )
A. 都是金屬元素 B. 原子半徑相差不大
C. 最外層電子數相同 D. 最高化合價相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com