
| A. | 簡單氫化物的穩定性:R>B>C | |
| B. | R分別與A、B、C均組成共價化合物 | |
| C. | 單質的沸點:R>B>A>C | |
| D. | 最高價氧化物對應的水化物的酸性:C>B |
分析 短周期主族元素R、A、B、C的原子序數依次增大.C原子的最內層電子數和次外層電子數之和等于最外層電子數的兩倍,原子有3個電子層,最外層電子數為5,故C為P元素;B在周期表中主族序數等于最內層電子數的2倍,則B處于IVA族,常溫常壓下BR4呈氣態,R表現-1價,R為H元素或ⅦA族元素,若R為H元素,R、A原子的最外層電子數之和等于B、C原子的最外層電子數之和,即A元素原子最外層電子數為5+4-1=8,不符合題意,可推知B為Si,R為F元素,則A元素原子最外層電子數為5+4-7=2,原子序數介于氟、Si之間,故A為Mg.
解答 解:短周期主族元素R、A、B、C的原子序數依次增大.C原子的最內層電子數和次外層電子數之和等于最外層電子數的兩倍,原子有3個電子層,最外層電子數為5,故C為P元素;B在周期表中主族序數等于最內層電子數的2倍,則B處于IVA族,常溫常壓下BR4呈氣態,R表現-1價,R為H元素或ⅦA族元素,若R為H元素,R、A原子的最外層電子數之和等于B、C原子的最外層電子數之和,即A元素原子最外層電子數為5+4-1=8,不符合題意,可推知B為Si,R為F元素,則A元素原子最外層電子數為5+4-7=2,原子序數介于氟、Si之間,故A為Mg.
A.非金屬性R(氟)>C(P)>B(Si),故氫化物穩定性R(氟)>C(P)>B(Si),故A錯誤;
B.氟分別與磷、硅組成共價化合物,但氟與Mg組成離子化合物,故B錯誤;
C.常溫下氟氣為氣體,其它三種單質均為固體,氟氣的沸點最低,故C錯誤;
D.非金屬性C(P)>B(Si),非金屬性越強,最高價含氧酸的酸性越強,故最高價氧化物對應的水化物的酸性:C>B,故D正確.
故選:D.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,屬于易錯題目,學生容易根據BR4呈氣態判斷R為H元素,而忽略四氟化硅,導致無法推斷元素,難度較大.


 培優口算題卡系列答案
培優口算題卡系列答案 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案 A加金題 系列答案
A加金題 系列答案科目:高中化學 來源: 題型:填空題
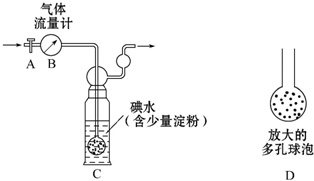 硫酸工業尾氣中二氧化硫含量超過0.05%(體積分數)時需經處理后才能排放.某化學研究性學習小組的同學欲采用以下方案測定硫酸工業尾氣中SO2含量
硫酸工業尾氣中二氧化硫含量超過0.05%(體積分數)時需經處理后才能排放.某化學研究性學習小組的同學欲采用以下方案測定硫酸工業尾氣中SO2含量查看答案和解析>>
科目:高中化學 來源: 題型:解答題
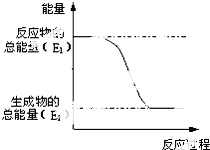 (1)“西氣東輸”中的“氣”指天然氣,其主要成分的化學式是CH4,
(1)“西氣東輸”中的“氣”指天然氣,其主要成分的化學式是CH4,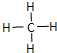 .一定量的該氣體燃燒過程的能量變化如圖所示,從圖中可以讀出E1>E2(填“>”或“<”),該反應放出 (填“放出”或“吸收”)能量.
.一定量的該氣體燃燒過程的能量變化如圖所示,從圖中可以讀出E1>E2(填“>”或“<”),該反應放出 (填“放出”或“吸收”)能量.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
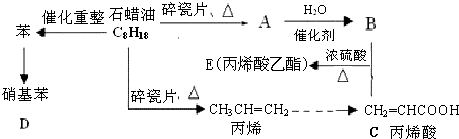
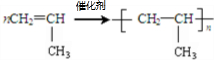 ;反應類型加聚反應.
;反應類型加聚反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實 驗 事 實 | 結 論 | |
| A | A、B兩種有機物具有相同的相對分子質量和不同的結構 | A、B互為同分異構體 |
| B | 質量相同的A、B兩種有機物完全燃燒生成質量相同的水 | A、B兩有機物最簡式相同 |
| C | A、B兩種有機物結構相似具有相同的通式 | A、B互為同系物 |
| D | 分子式為C6H6的烴A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的結構簡式可能是 CH2═CH-C≡C-CH═CH2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 金屬 | 電壓表指針偏轉方向 | 電壓/V |
| Al | 指向Cu | +0.78 |
| 甲 | 指向甲 | -0.15 |
| 乙 | 指向Cu | +1.35 |
| Fe | 指向Cu | +0.30 |
| 丙 | 指向Cu | +0.45 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
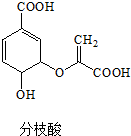
| A. | 可與乙醇、乙酸反應,且反應類型相同 | |
| B. | 分子中含有2種官能團 | |
| C. | 1mol分枝酸最多可與3molNaOH發生中和反應 | |
| D. | 可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com