
【題目】現有下列濃度均為0.1 mol/L的電解質溶液:
①Na2CO3、② NaHCO3、③![]() 、④CH3COONH4、⑤ NH4HCO3
、④CH3COONH4、⑤ NH4HCO3
(1)上述5種物質的溶液既能與鹽酸又能與燒堿溶液反應的是(填寫序號) 。
(2)已知溶液④呈中性,該溶液中離子濃度由大到小的順序是 。
(3)已知溶液⑤呈堿性,比較④、⑤兩溶液的酸堿性,可以得出的結論是 。
【答案】(1)②④⑤(2分)
(2)c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)
(3)HCO3-的水解程度比CH3COO-大或CH3COOH酸性比H2CO3強
【解析】
試題分析:(1)碳酸氫鈉能和鹽酸反應生成氯化鈉和水和二氧化碳,碳酸氫鈉能和氫氧化鈉反應生成碳酸鈉和水,醋酸銨和鹽酸反應生成氯化銨和醋酸,也和氫氧化鈉反應生成氨氣和水和醋酸鈉,碳酸氫銨和鹽酸反應生成氯化銨和水和二氧化碳,也和氫氧化鈉反應生成碳酸銨和碳酸鈉和水,所以選②④⑤。
(2)醋酸銨溶液為中性,說明氫離子濃度等于氫氧根離子濃度,則根據電荷守恒可以知道醋酸根離子濃度等于銨根離子濃度,所以有c(CH3COO-)=c(NH4+)>c(OH-)= c(H+)。
(3)碳酸氫銨顯堿性,說明碳酸氫根的水解程度比銨根離子水解程度大,而根據醋酸銨溶液顯中性分析,醋酸根離子水解程度等于銨根離子水解程度,所以可以得出碳酸氫根離子水解程度比醋酸根大或醋酸酸性比碳酸強。


科目:高中化學 來源: 題型:
【題目】如下圖,CPAE是蜂膠的主要活性成分,也可由咖啡酸合成.下列說法不正確的是

A.咖啡酸分子中所有碳原子可能處在同一個平面上
B.1molCPAE與足量的溴水反應,最多消耗3molBr2
C.1mol苯乙醇在O2中完全燃燒,需消耗10molO2
D.1molCPAE與足量的NaOH溶液反應,最多消耗3molNaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,將乙針筒內的物質壓到甲針筒內,進行下表所列實驗,對實驗現象的描述錯誤的是
(氣體在同溫同壓下測定)
![]()
選項 | 甲針筒內物質 | 乙針筒內物質 | 甲針筒的現象 |
A | 20mLH2S | 10mLSO2 | 生成黃色固體,活塞自動向內壓縮 |
B | 1g薄銅片 | 10mL12mol/L濃硝酸 | 生成棕色氣體、溶液呈綠色,活塞自動外移,Cu有剩余 |
C | 30mLNO2 | 10mL水(液態) | 剩有無色氣體,活塞自動向內壓縮 |
D | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,最終沉淀轉變為紅褐色 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T時,向2.0L恒容密閉容器中充入1.0mol PCl5,反應PCl5(g)![]() PCl3(g)+Cl2(g)經一段時間后達到平衡.反應過程中測定的部分數據見下表:
PCl3(g)+Cl2(g)經一段時間后達到平衡.反應過程中測定的部分數據見下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列說法正確的是
A.反應在前50s的平均速率為v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他條件不變,升高溫度,平衡時,c(PCl3)=0.11molL﹣1,則反應的△H<0
C.相同溫度下,起始時向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,達到平衡前v(正)>v(逆)
D.相同溫度下,起始時向容器中充入2.0mol PCl3、2.0mol Cl2,達到平衡時,PCl3的轉化率小于80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應中,元素X的原子將電子轉移給元素Y的原子,則下列說法正確的是( )
①元素X被氧化 ②元素Y被氧化 ③元素X發生還原反應 ④元素Y發生還原反應
A.①② B.③④
C.②③ D.①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2molPCl3和1molCl2充入體積不變的密閉容器中,在一定條件下發生下述反應:PCl3(g)+Cl2(g) ![]() PCl5(g),達平衡時PCl5為0.4mol,如果此時移走1.0molPCl3和0.5molCl2,在相同溫度下再達平衡時PCl5的物質的量是
PCl5(g),達平衡時PCl5為0.4mol,如果此時移走1.0molPCl3和0.5molCl2,在相同溫度下再達平衡時PCl5的物質的量是
A.0.4mol B.小于0.2mol
C.大于0.2mol D.大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳與濃硫酸共熱產生的氣體X和銅與濃硝酸反應產生的氣體Y同時通入盛有足量氯化鋇溶液的洗氣瓶中(如圖裝置),下列有關說法不正確的是( )
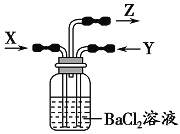
A.在Z導管中有紅棕色氣體出現
B.在Z導管出來的氣體中有二氧化碳
C.洗氣瓶中產生的沉淀是硫酸鋇
D.洗氣瓶中產生的沉淀是碳酸鋇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“綠色化學實驗”進課堂,某化學教師為氯氣與金屬鈉反應設計了如下裝置與操作以替代相關的課本實驗。實驗操作:鈉與氯氣反應的裝置作如下圖改進,將一根玻璃管與氯氣發生器相連,玻璃管內放一塊黃豆粒大的金屬鈉(已吸凈煤油),玻璃管尾部塞一團浸有NaOH溶液的棉花球。先給鈉預熱,到鈉熔融成圓球時,撤火,通入氯氣,即可見鈉著火燃燒,生成大量白煙。以下敘述錯誤的是( )
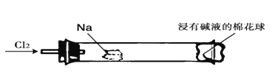
A. 反應生成的大量白煙是氯化鈉晶體
B. 玻璃管尾部塞一團浸有NaOH溶液的棉球是用于吸收過量的氯氣,以免其污染空氣
C. 鈉著火燃燒產生蒼白色火焰
D. 若在棉球外沿滴一滴淀粉碘化鉀溶液,據其顏色變化判斷氯氣是否被堿液完全吸收
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com