
| 化學式 | 電離平衡常數 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
分析 (1)酸的電離平衡常數越大,其酸根離子水解程度越小,則相同濃度的鈉鹽溶液堿性越弱;
(2)NaCN和少量CO2反應生成NaHCO3、HCN;
(3)將0.02mol/L的HCN與0.01mol/L 的NaOH溶液等體積混合,溶液中的溶質是等物質的量濃度的NaCN、HCN,已知混合溶液中c(CN-)<c(Na+),根據電荷守恒可知c(H+)<c(OH-),混合溶液呈堿性,說明CN-的水解程度大于HCN的電離程度,據此進行判斷;
(4)鋁離子與碳酸氫根離子發生雙水解反應生成二氧化碳氣體和氫氧化鋁沉淀;
(5)根據草酸氫銨溶液顯示酸性及電荷守恒判斷溶液中各離子濃度大小.
解答 解:(1)電離平衡常數,CH3COOH>H2CO3>HCN,等濃度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度為:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH為:Na2CO3>NaCN>CH3COONa,
故答案為:b>a>c;
(2)NaCN和少量CO2反應生成NaHCO3、HCN,反應方程式為:NaCN+CO2+H2O=NaHCO3+HCN,
故答案為:NaCN+CO2+H2O=NaHCO3+HCN;
(3)將0.02mol/L的HCN與0.01mol/L 的NaOH溶液等體積混合,溶液中的溶質是物質的量濃度都為0.005mol•L-1的NaCN、HCN,測得c(Na+)>c(CN-),根據電荷守恒可知:c(H+)<c(OH-),溶液呈堿性,所以HCN的濃度為0.005mol•L-1,CN-的濃度小于0.005mol•L-1,
A.根據分析可知,溶液呈堿性,c(H+)<c(OH-),故A錯誤;
B.混合液呈堿性,則c(H+)<c(OH-),故B正確;
C.氫氧根離子濃度較小,c(CN-)遠遠大于c(OH-),故C錯誤;
D.根據物料守恒可知:c(HCN)+c(CN-)=0.01mol/L,故D正確;
故答案為:BD;
(4)鋁離子與碳酸氫根離子混合發生雙水解生成氫氧化鋁沉淀和二氧化碳氣體,反應的離子方程式為:Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案為:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(5)草酸氫鈉溶液顯示酸性,則HC2O4-的電離程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氫離子來自水的電離和HC2O4-的電離,則c(H+)>c(C2O42-),HC2O4-的水解程度較小,則c(HC2O4-)>c(C2O42-),所以溶液中各離子濃度大小為:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案為:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
點評 本題考查了弱電解質的電離及其影響、離子濃度大小比較、原電池工作原理的應用等知識,題目難度中等,明確弱電解質的電離平衡及其影響因素、原電池工作原理為解答關鍵,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
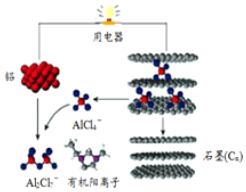 一種能快速充電的超常性能電池-鉛離子電池.或許能更好的解決電網電力的存儲、協調、平衡問題.該電池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有機陽離子組成電解質溶液.放電時的工作原理如圖所示.下列觀點正確的是( )
一種能快速充電的超常性能電池-鉛離子電池.或許能更好的解決電網電力的存儲、協調、平衡問題.該電池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有機陽離子組成電解質溶液.放電時的工作原理如圖所示.下列觀點正確的是( )| A. | 該電池充電時的電子流向為:鋁→用電器→石墨(C) | |
| B. | 該電池放電時石墨電極發生氧化反應 | |
| C. | 充電時的陰極反應為:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 放電時,有機陽離子向鋁電極方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3種溶液pH的大小順序是 ③>②>① | |
| B. | 若將3種溶液稀釋相同倍數,pH變化最大的是① | |
| C. | 若分別加入25mL 0.1mol•L-1鹽酸后,pH最小的是② | |
| D. | 若升高溫度,則③的pH不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用丁達爾現象區分溶液與膠體 | |
| B. | 用蒸餾的方法除去自來水中含有的Cl- | |
| C. | 用萃取的方法從某些植物中提取香料或中藥成份 | |
| D. | 金屬鈉長期暴露在空氣中的最終產物是NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c=$\frac{Vρ}{17V+22400}$ | B. | ω=$\frac{17c}{100ρ}$ | ||
| C. | ω=$\frac{17V}{17V+22400}$ | D. | ρ=$\frac{17V+22400}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)甲醇(CH3OH)是一種重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一種重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg和Al都可以用電解法冶煉得到 | |
| B. | Na2O2、Na2O組成元素相同,與CO2反應產物也相同 | |
| C. | 用過量的KSCN溶液除去FeCl2溶液中的少量FeCl3 | |
| D. | Na和Fe在一定條件下與水反應都生成H2和對應的堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用催化劑可以加快反應速率 | |
| B. | 增大壓強可以加快反應速率 | |
| C. | 反應達到平衡時,v(正)=v(逆) | |
| D. | 增大O2的量可以使NH3100%轉變為NO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加催化劑,v正、v逆都發生變化,且變化的倍數相等 | |
| B. | 加壓、v正、v逆都增大,且v正大于v逆 | |
| C. | 降溫,v正、v逆減小,且v正小于v逆 | |
| D. | 體積不變,加入氮氣,v正、v逆都增大,且v正大于v逆 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com