


 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源:不詳 題型:單選題
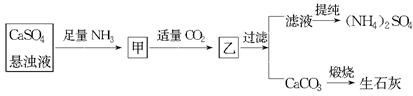
| A.直接蒸干濾液得到純凈的(NH4)2SO4 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.CO2可被循環使用 |
| D.往甲中通入CO2有利于(NH4)2SO4生成 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
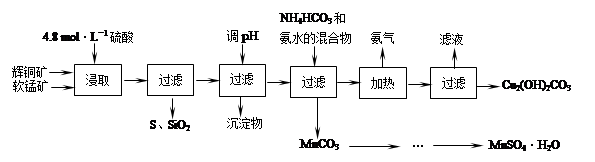
| | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.電解法制金屬鈉時,負極反應式:Na++e-=Na |
| B.電解法生產鋁時,需對鋁土礦進行提純,在提純過程中應用了氧化鋁或氫氧化鋁的兩性 |
| C.在氯堿工業中,電解池中的陰極產生的是H2 , NaOH 在陽極附近產生 |
| D.氯堿工業和金屬鈉的冶煉都用到了NaCl ,在電解時它們的陰極都是 C1一失電子 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
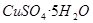 。
。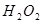 溶液,稍加熱。
溶液,稍加熱。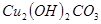 粉末至
粉末至 為
為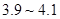 。
。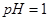 。
。 如下表:
如下表:| 物質 |  | 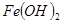 | 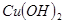 |
開始沉淀 | 2.7 | 7.6 | 4.7 |
完全沉淀 | 3.7 | 9.6 | 6.7 |
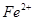 氧化為
氧化為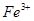 的目的是 。
的目的是 。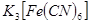 (鐵氰化鉀)驗證II中
(鐵氰化鉀)驗證II中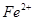 是否轉化完全的現象是 。
是否轉化完全的現象是 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 已知:pH≥9.6時,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4時,Cu2+以Cu(OH)2的形式完全沉淀;常溫時Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。試回答:
已知:pH≥9.6時,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4時,Cu2+以Cu(OH)2的形式完全沉淀;常溫時Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。試回答:
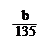 mol
mol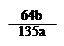 ×100℅
×100℅ 查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
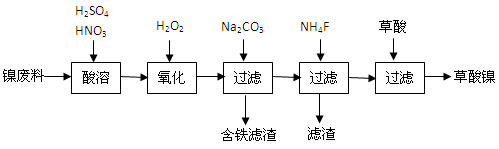
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
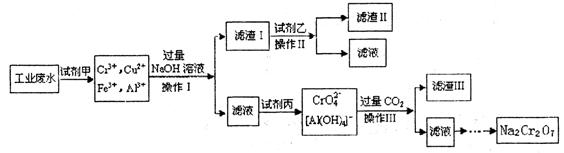
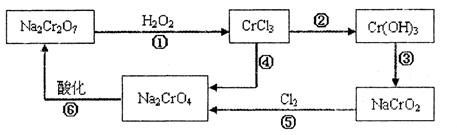
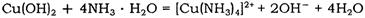
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com