
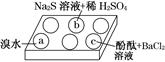
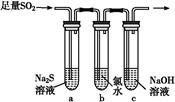
| 編號 | 實驗現象 |
| a | 溴水褪色 |
| b | 產生淡黃色沉淀 |
| c | 滴入酚酞溶液變紅,再加入BaCl2溶液后產生沉淀且紅色褪去 |
 HSO3-+OH-,所以滴入酚酞后溶液變紅;在該溶液中加入 BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)減小,SO32-水解平衡左移,c(OH-)減小,紅色褪去。
HSO3-+OH-,所以滴入酚酞后溶液變紅;在該溶液中加入 BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)減小,SO32-水解平衡左移,c(OH-)減小,紅色褪去。

科目:高中化學 來源:不詳 題型:填空題
| A.碘的淀粉溶液 | B.酸性高錳酸鉀溶液 |
| C.氫氧化鈉溶液 | D.氯化鋇溶液 |
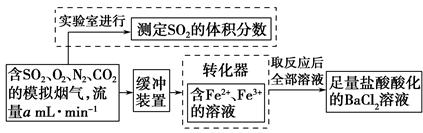
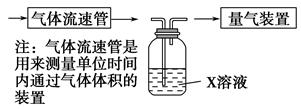
 的轉化率,已知氣體流速,還需測定的數據有 、 。
的轉化率,已知氣體流速,還需測定的數據有 、 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.新制的氯水 | B.品紅溶液 | C.滴有酚酞的NaOH稀溶液 | D.H2S氣體 |
| 性質 | 試劑 | 化學方程式 |
| 漂白性 | | |
| 氧化性 | | |
| 還原性 | | |
| 酸性氧化物 | | |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
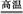 8SO2+2Fe2O3,該反應中被氧化的元素是 (填元素符號)。當該反應轉移2.75 mol電子時,生成的二氧化硫在標準狀況下的體積為 L。
8SO2+2Fe2O3,該反應中被氧化的元素是 (填元素符號)。當該反應轉移2.75 mol電子時,生成的二氧化硫在標準狀況下的體積為 L。 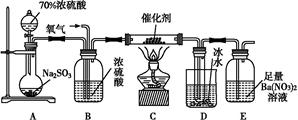
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
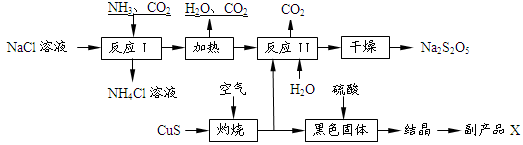
 Na2S2O5+H2O等多步反應。
Na2S2O5+H2O等多步反應。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
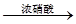 H2SO4
H2SO4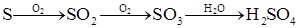
| A.途徑①反應中體現了濃硝酸的強氧化性和酸性 |
| B.途徑②的第二步反應在實際生產中可以通過增大O2濃度來降低成本 |
| C.由途徑①和②分別制取1 mol H2SO4,理論上各消耗1 mol S,各轉移6 mol e- |
| D.途徑②與途徑①相比更能體現“綠色化學”的理念是因為途徑②比途徑①污染相對小且原子利用率高 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.通過品紅溶液 |
| B.通過澄清石灰水 |
| C.先通過氫氧化鈉溶液,再通過澄清石灰水 |
| D.先通過酸性高錳酸鉀溶液,再通過澄清石灰水 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com