
化學(xué)反應(yīng)C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0達(dá)到平衡,下列敘述中正確的是 ( )
CO(g)+H2(g) ΔH>0達(dá)到平衡,下列敘述中正確的是 ( )
A.升高溫度,正反應(yīng)速率增大,逆反應(yīng)速率減小,平衡向正反應(yīng)方向移動(dòng)
B.加入固體碳,平衡向正反應(yīng)方向移動(dòng)
C.加入水蒸氣使容器內(nèi)壓強(qiáng)增大,平衡向逆反應(yīng)方向移動(dòng)
D.?dāng)U大容器容積,平衡向正反應(yīng)方向移動(dòng)
D
此題是對(duì)化學(xué)反應(yīng)速率與化學(xué)平衡的影響因素的考查,改變條件引起化學(xué)反應(yīng)速率的變化,從而影響化學(xué)平衡移動(dòng)。升高溫度,正、逆速率都增大,故A錯(cuò)誤;加入固體碳,沒(méi)有引起濃度的改變,平衡不移動(dòng),故B錯(cuò)誤;加入水蒸氣使容器內(nèi)壓強(qiáng)增大,只是水蒸氣的濃度增大,而一氧化碳和氫氣的濃度沒(méi)有改變,平衡向正反應(yīng)方向移動(dòng),故C錯(cuò)誤;擴(kuò)大容器容積,減小壓強(qiáng),對(duì)于C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0,正反應(yīng)方向是體積增大,所以,平衡向正反應(yīng)方向移動(dòng),故D正確。
CO(g)+H2(g) ΔH>0,正反應(yīng)方向是體積增大,所以,平衡向正反應(yīng)方向移動(dòng),故D正確。



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
化學(xué)反應(yīng)C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0達(dá)到平衡,下列敘述中正確的是 ( )
CO(g)+H2(g) ΔH>0達(dá)到平衡,下列敘述中正確的是 ( )
A.升高溫度,正反應(yīng)速率增大,逆反應(yīng)速率減小,平衡向正反應(yīng)方向移動(dòng)
B.加入固體碳,平衡向正反應(yīng)方向移動(dòng)
C.加入水蒸氣使容器內(nèi)壓強(qiáng)增大,平衡向逆反應(yīng)方向移動(dòng)
D.?dāng)U大容器容積,平衡向正反應(yīng)方向移動(dòng)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2013屆湖北宜昌金東方學(xué)校高二上學(xué)期期末考試化學(xué)試卷(解析版) 題型:選擇題
下列與化學(xué)反應(yīng)能量變化相關(guān)的敘述正確的是
A.生成物的總能量一定低于反應(yīng)物總能量
B.放熱反應(yīng)的反應(yīng)速率一定大于吸熱反應(yīng)的反應(yīng)速率
C.同溫同壓下,H2(g)+Cl2(g)=2HCl(g) 在光照和點(diǎn)燃條件的△H不同
D.用C(s)和CO(g)的燃燒熱數(shù)據(jù),可以計(jì)算化學(xué)反應(yīng)C(s)+1/2O2(g)=CO(g)的焓變
查看答案和解析>>
科目:高中化學(xué) 來(lái)源:2010年福建省福州市八縣(市)協(xié)作校第一學(xué)期期中聯(lián)考高二理科化學(xué)試卷 題型:選擇題
已 知化學(xué)反應(yīng)C(s)+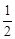 O2(g)==CO(g);△H= — Q1 kJ/mol,
O2(g)==CO(g);△H= — Q1 kJ/mol,
2CO (g)+O2(g)==2CO2(g);△H= — Q2 kJ/mol。
據(jù)此推斷,下列說(shuō)法正確的是(Q1、Q2均為正數(shù),且其他條件相同)( )
A.碳的燃燒熱為Q1 kJ/mol
B.2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量
C.一定質(zhì)量的碳燃燒,生成CO2(g)比生成CO(g)時(shí)放出的熱量多
D.碳燃燒生成CO2氣體的熱化學(xué)方程式為:
C(s)+ O2(g)==CO2(g);△H= —(Q1 +Q2)kJ/mol
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com