
| 物質 | X | Y | Z | Q |
| 時間 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
分析 (1)2min內Z的反應速率v(Z)=$\frac{\frac{△n}{V}}{△t}$;
(2)根據Z的反應速率計算Y的反應速率,根據△n=v△tV計算Y、Q參加反應的物質的量,從而確定反應開始n(Y)、n(Q);
(3)計算X的平均反應速率,同一可逆反應同一時間段內各物質的反應速率之比等于其計量數之比;
(4)增大反應物濃度、升高溫度、增大壓強、加入催化劑等方法都能正反應速率.
解答 解:(1)2min內Z的反應速率v(Z)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1-0.8}{2}}{2}$mol•L-1•min-1=0.05 mol•L-1•min-1,
故答案為:0.05 mol•L-1•min-1;
(2)v(Z):v(Y)=1:2,則v(Y)=2v(Z)=2×0.05 mol•L-1•min-1=0.1 mol•L-1•min-1,
參加反應的△n(Y)=v(Y)△tV=0.1mol/(L.min)×2L×2min=0.4mol,則反應初始n(Y)=2.7mol-0.4mol=2.3mol
2min內v(Q)=0.075mol•L-1•min-1,參加反應的△n(Q)=v(Q)△tV=0.075mol/(L.min)×2L×2min=0.3mol,則反應初始n(Q)=2.7mol+0.3mol=3mol;
故答案為:2.3 mol;3 mol;
(3)v(X)=$\frac{\frac{0.8-0.7}{2}}{2}$mol/(L.min)=0.025mol/(L.min),同一可逆反應中同一段時間內各物質的反應速率之比等于其計量數之比,所以m:n:p:q=0.025mol/(L.min):0.1 mol•L-1•min-1:0.05 mol•L-1•min-1:0.075mol•L-1•min-1=1:4:2:3,
故答案為:1;4;2;3;
(4)增大反應物濃度、升高溫度、增大壓強、加入催化劑等方法都能正反應速率,所以符合條件的只有CD,故答案為:C D.
點評 本題考查化學平衡計算及外界條件對化學反應速率影響,為高頻考點,側重考查學生分析判斷及計算能力,熟練掌握化學反應速率計算有關公式,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
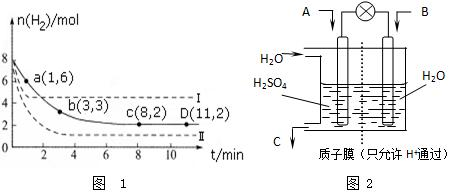
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 容量 | 甲 | 乙 | 丙 | 丁 |
| A | 2mol | 1mol | 2mol | 1mol |
| B | 1mol | 1mol | 2mol | 2mol |
| A. | A的轉化率:丁>丙>乙>甲 | B. | A的轉化率:丁>乙>丙>甲 | ||
| C. | B的轉化率:丙>甲>乙>丁 | D. | B的轉化率:甲>乙>丙>丁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 甲 | 乙 | 丙 | 丁 | ||
| 密閉容器體積/L | 2 | 2 | 2 | 1 | |
| 起始物質的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡轉化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反應的平衡常數小于乙 | |
| B. | 該溫度下,該反應的平衡常數K為400 | |
| C. | SO2的平衡轉化率:α1>α2=α3 | |
| D. | 容器中SO3的物質的量濃度:丙=丁<甲 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
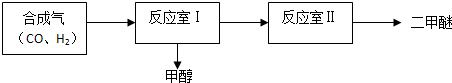
| 序號 | 溫度(°C) | 起始濃度(mol•L-1) | 平衡濃度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
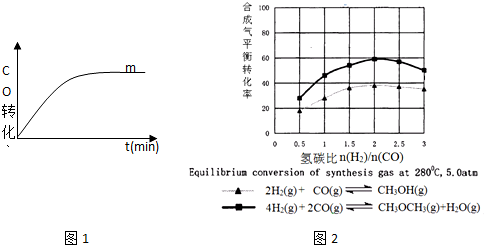
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
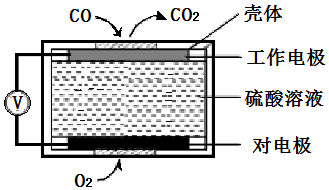
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的體積(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 錐形瓶中溶液 | 滴定管中溶液 | 選用指示劑 | 選用滴定管 | |
| A | 堿 | 酸 | 石蕊 | (乙) |
| B | 酸 | 堿 | 甲基橙 | (甲) |
| C | 堿 | 酸 | 酚酞 | (甲) |
| D | 酸 | 堿 | 酚酞 | (乙) |
| 醋酸濃度(mol•L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com