
| 元素編號 | 元素性質或原子結構 |
| T | 最高正價與最低負價的代數和為4 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物的水溶液呈堿性 |
| Z | 最高正價是+7價 |
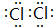 ;Y的氫化物的水溶液顯堿性的原因為NH3+H2O?NH3•H2O?NH4++OH-(用離子方程式表示).
;Y的氫化物的水溶液顯堿性的原因為NH3+H2O?NH3•H2O?NH4++OH-(用離子方程式表示).分析 短周期元素中,T元素的最高正價與最低負價的代數和為4,則T為S元素;X元素原子最外層電子數是次電子數次外層電子數的2倍,原子只能有2個電子層,最外層電子數為4,故X為C元素;常溫下Y元素單質為雙原子分子,其氫化物的水溶液呈堿性,則Y為N元素;Z元素的最高正價是+7價,則Z為Cl,結合對應單質、化合物的性質以及元素周期率解答該題.
解答 解:(1)T為S元素,在元素周期表中的位置為:第三周期第ⅥA族,故答案為:第三周期第ⅥA族;
(2)X的一種同位素可用于測定文物年代,該同位素為,故答案為:614C;
(3)Z單質為Cl2,電子式為 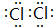 ;Y的氫化物為NH3,其水溶液顯堿性的原因為:NH3+H2O?NH3•H2O?NH4++OH-,
;Y的氫化物為NH3,其水溶液顯堿性的原因為:NH3+H2O?NH3•H2O?NH4++OH-,
故答案為: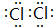 ;NH3+H2O?NH3•H2O?NH4++OH-;
;NH3+H2O?NH3•H2O?NH4++OH-;
(4)同周期自左而右非金屬性減弱,Cl元素非金屬性比硫的強,
a.物理性質不能說明非金屬性強弱,故a錯誤;
b.氫化物酸性不能比較元素非金屬性強弱,故b錯誤;
c.元素非金屬性強弱與獲得電子能力強弱有關,與最高正化合價無關,故c錯誤;
c.非金屬性越強,最高價氧化物對應水化物的酸性越強,故d正確;
故答案為:Cl;d.
(5)Z的氫化物為HCl,Y的氫化物為NH3,二者發生化合反應生成NH4Cl,反應的化學方程式為HCl+NH3=NH4Cl,NH4Cl中含有離子鍵、共價鍵,
故答案為:HCl+NH3=NH4Cl;離子鍵、共價鍵.
點評 本題考查結構性質位置關系綜合應用,為高考常見題型,側重于學生的分析能力的考查,難度不大,推斷元素是解題關鍵,注意掌握金屬性、非金屬性強弱比較實驗事實.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反應的△H=-198kJ/mol,是放熱反應.當壓強一定時,溫度升高,平衡左移,SO2平衡轉化率減小.
2SO3反應的△H=-198kJ/mol,是放熱反應.當壓強一定時,溫度升高,平衡左移,SO2平衡轉化率減小.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
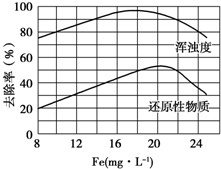 FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小.請回答下列問題:
FeCl3具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3高效,且腐蝕性小.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 方法1 | 用氨水將SO2轉化為NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤氣(主要成分為CO、H2等)將SO2在高溫下還原成單質硫 |
| 方法3 | 用Na2SO3溶液吸收SO2轉化為NaHSO3,再經電解轉化為H2SO4 |
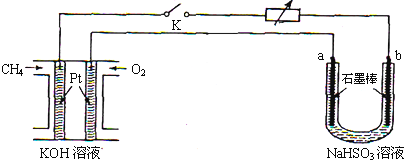
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
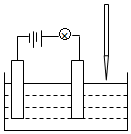 在電解質溶液的導電性實驗(裝置如圖所示)中,若向某一電解質溶液中逐滴加入另一溶液時,則燈泡由亮變暗,至熄滅后又逐漸變亮的是( )
在電解質溶液的導電性實驗(裝置如圖所示)中,若向某一電解質溶液中逐滴加入另一溶液時,則燈泡由亮變暗,至熄滅后又逐漸變亮的是( )| A. | 醋酸中逐滴加入氫氧化鈉溶液 | B. | 硫酸鈉中逐滴加入氫氧化鋇溶液 | ||
| C. | 硫酸中逐滴加入氫氧化鋇溶液 | D. | 鹽酸中逐滴加入硝酸銀溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com