
I.下列說法中正確的是 。
A.第一電離能由大到小的順序為O>N>C
B.由于C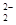 和O
和O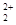 互為等電子體,所以可以推斷O
互為等電子體,所以可以推斷O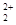 的電子式為
的電子式為
C.根據巖漿晶出規則,Ca0比Mg0更容易在巖漿冷卻過程中先結晶
D.液態HF通常也可以寫成(HF)n的形式,是因為液態HF分子間存在氫鍵
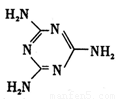
Ⅱ.(1)蘭聚氰胺分子的結構簡式如圖所示,則其中氮原子軌道雜化類型是 ,l mol三聚氰胺分子中含 mol 鍵。
鍵。
(2)某元素位于第四周期VIII族,其基態原子的未成對電子數與基態碳原子的未成對電子數相同,則其基態原子的M層電子排布式為____ 。
(3)過渡金屬配合物Ni( CO)n的中心原子價電子數與配體提供電子總數之和為18,則n=____ 。
(4)碳化硅的晶胞結構(如右圖)與金剛石類似(其中“●”為碳原子,“○”為硅原子)。圖中“●”點構成的堆積方式與下列圖式中 所表示的堆積方式相同。
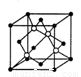

(5)碳化硅的結構中,與碳原子距離最近且相等的碳原子有 個。設晶胞邊長為a cm,碳原子直徑為b cm,硅原子直徑為c cm,則該晶胞的空間利用率為 (用含a、b、c的式子表示)。
Ⅰ BD(3分)
Ⅱ (1)sp2、sp3 (2分) 15(1分)
(2)3s23p63d8(2分)
(3)4(2分)
(4)D(2分)
(5)12(1分) [2π(b3+c3)/3a3]×100%(2分)
【解析】I.A.不正確,第一電離能由大到小的順序為N>O>C,N的2P能級是半充滿結構,比較穩定;
B.正確,由于C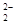 和O
和O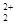 互為等電子體,結構相似;
互為等電子體,結構相似;
C.不正確,根據巖漿晶出規則:晶體從巖漿析晶難易程度不僅與巖漿的組成有關而且也與析出晶體的晶格能大小有關:晶格能高的晶體熔點較高更容易在巖漿冷卻過程中先結晶,Mg0比Ca0更容易在巖漿冷卻過程中先結晶。
D.正確,液態HF通常也可以寫成(HF)n的形式,F原子電負性大,液態HF分子間存在氫鍵。
答案:B D
Ⅱ⑴六元環上的N是sp2雜化,氨基上的N是sp3雜化;l mol三聚氰胺分子中含 (6+3×3)mol=15mol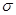 鍵,答案:sp2雜化、sp3雜化,15mol。
鍵,答案:sp2雜化、sp3雜化,15mol。
⑵第四周期VIII族有Fe、CO、Ni三種原子,基態碳原子的未成對電子數是2,三種原子中基態未成對電子數是2的是Ni,基態原子的M層電子排布式為3S23P63d8,答案:3S23P63d8
⑶Ni:3d8 4s2 為10e,CO:2e,10e + 2e×n = 18,n = 4,CO中只有C提供孤對電子,而C只有一對孤電子對;答案:4;
⑷碳原子構成的堆積方式與D相同,答案:D。
⑸碳化硅的結構中,與碳原子距離最近且相等的碳原子有12個;該晶胞中C為8×1/8+6×1/2=4,Si原子是4個,球體積公式為V=4/3πR3,原子體積=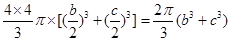 ,空間的利用率為
,空間的利用率為
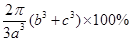 ,答案:12,
,答案:12,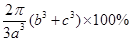 。
。
考點:物質的結構,核外電子排布,分子結構、晶體結構、空間利用率計算


科目:高中化學 來源: 題型:
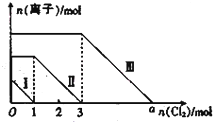 向僅含Fe2+、I-、Br-的溶液通入適量氯氣,溶液中這三種離子的物質的量的變化如圖所示.下列說法中正確的是( )
向僅含Fe2+、I-、Br-的溶液通入適量氯氣,溶液中這三種離子的物質的量的變化如圖所示.下列說法中正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:同步題 題型:不定項選擇題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com