
| 選項 | 實驗目的 | 實驗方案 |
| A | 驗證二氧化硫漂白性 | 二氧化硫通入溴水中,看溶液顏色是否褪色 |
| B | 檢驗氯化鐵溶液中是否含FeCl2 | 向氯化鐵溶液中滴加氫氧化鈉溶液 |
| C | 檢驗食鹽中是否添加KIO3 | 取食鹽試樣,溶于KI溶液,加入淀粉溶液,觀察溶液是否變藍 |
| D | 驗證Ksp(AgI)>Ksp(AgCl) | 向含等物質的量NaCl、KI的混合液中滴加AgNO3溶液,觀察沉淀顏色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫能被強氧化劑氧化而體現還原性;
B.亞鐵離子和氫氧根離子反應生成白色氫氧化亞鐵沉淀,但立即轉化為灰綠色,最終轉化為紅褐色;
C.淀粉遇碘單質變藍,且有酸性條件下,I-才能還原IO3-;
D.溶度積常數大的物質能轉化為溶度積常數小的物質.
解答 解:A.二氧化硫能被強氧化劑氧化而體現還原性,溴具有強氧化性,二氧化硫和溴發生氧化還原反應而使溴水褪色,體現二氧化硫還原性而不是漂白性,故A錯誤;
B.亞鐵離子和氫氧根離子反應生成白色氫氧化亞鐵沉淀,但立即轉化為灰綠色,最終轉化為紅褐色,且鐵離子和氫氧根離子生成的氫氧化鐵顏色覆蓋氫氧化亞鐵顏色,所以無法檢驗,故B錯誤;
C.只有酸性條件下,I-才能還原IO3-,發生5I-+IO3-+6H+=3I2+3H2O,生成的單質碘遇淀粉變藍,則該實驗沒有提供酸性條件,不能完成,故C錯誤;
D.先產生黃色沉淀,證明Ksp(AgI)<Ksp(AgCl),能達到實驗目的,故D正確;
故選D.
點評 本題考查化學實驗方案評價,為高頻考點,涉及二氧化硫性質、離子檢驗、氧化還原反應、難溶物轉化等知識點,把握物質的性質、反應原理為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
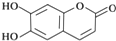
| A. | M的分子式是C9H6O4 | |
| B. | 1molM最多能與2molBr2發生反應 | |
| C. | M與足量的NaOH溶液發生反應時,所得有機產物的化學式為C9H4O5Na4 | |
| D. | 1molM與足量NaHCO3反應能生成2molCO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO4溶液中加入過量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 次氯酸鈣溶液中加入亞硫酸鈉:SO32-+Ca2+═CaSO3↓ | |
| C. | NH4HCO3溶液中加足量NaOH溶液共熱:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O | |
| D. | 硫酸亞鐵溶液中加入用硫酸酸化的雙氧水:2Fe2++2H++H2O2═2Fe3++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
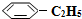 )可生產塑料單體苯乙烯(
)可生產塑料單體苯乙烯(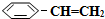 ),其原理反應是:
),其原理反應是: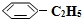 (g)?
(g)?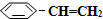 (g)+H2(g)△H=+125kJ•mol-1.
(g)+H2(g)△H=+125kJ•mol-1.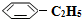 (g)充入2L真空密閉容器中發生反應,測定該容器內的物質,得到數據如下表:
(g)充入2L真空密閉容器中發生反應,測定該容器內的物質,得到數據如下表:| 時間/min | 0 | 10 | 20 | 30 | 40 |
n(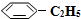 )/mol )/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(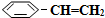 )/mol )/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
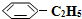 (g)的平衡轉化率與水蒸氣的用量、體系總壓強的關系如圖1所示.當其它條件不變時,水蒸氣的用量越大,平衡轉化率將越大(填“越大”、“越小”或“不變”),原因是體系總壓強一定時,水蒸氣的分壓越大,平衡體系的分壓越小,平衡向氣體體積增大的方向移動
(g)的平衡轉化率與水蒸氣的用量、體系總壓強的關系如圖1所示.當其它條件不變時,水蒸氣的用量越大,平衡轉化率將越大(填“越大”、“越小”或“不變”),原因是體系總壓強一定時,水蒸氣的分壓越大,平衡體系的分壓越小,平衡向氣體體積增大的方向移動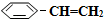 (g)和H2(g),假設在40min時達到上述同樣的平衡狀態,請在圖2中畫出并標明該條件下
(g)和H2(g),假設在40min時達到上述同樣的平衡狀態,請在圖2中畫出并標明該條件下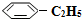 (g)和
(g)和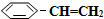 (g)的濃度c隨時間t變化的曲線.
(g)的濃度c隨時間t變化的曲線.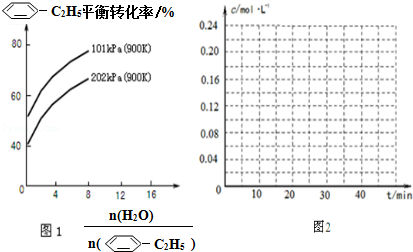
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
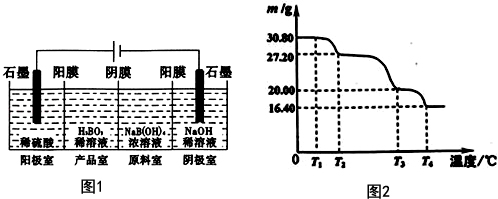 硼酸(H3BO3)與鋁酸(H3AlO3)結構相似,可寫成B(OH)3.
硼酸(H3BO3)與鋁酸(H3AlO3)結構相似,可寫成B(OH)3.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
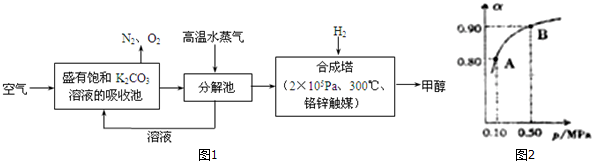
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com