
【題目】粉煤灰的綜合利既有利于節約資源又有利于保護環境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的鋁、鐵分離工藝流程如下:
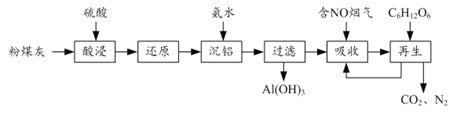
(1)①“酸浸”時Al2O3發生反應的離子方程式為______。
②當硫酸質量分數大于50%,金屬氧化物浸出率明顯下降。其原因是______。
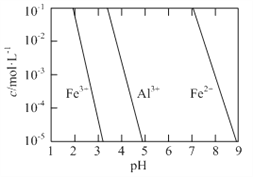
(2)有關金屬離子以氫氧化物沉淀時離子濃度隨pH變化如圖所示。若浸出液不經還原直接與氨水混合,鋁、鐵元素分離效果較差的原因是______。
(3)沉鋁后所得FeSO4溶液可用于煙氣中NO吸收,其原理為Fe2++2NO![]() [Fe(NO)2]2+,煙氣中O2的體積分數對NO吸收率的影響如圖所示。
[Fe(NO)2]2+,煙氣中O2的體積分數對NO吸收率的影響如圖所示。
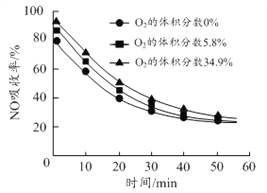
①為提高煙氣中NO 的吸收率,可采取的措施有______(答一條,并說明理由)。
②“再生”過程中,[Fe(NO)2]2+在微生物的作用下與C6H12O6發生反應的離子方程式為______。
(4)Al(OH)3經過一系列反應可獲得粗鋁,利用熔融狀態下物質密度不同,通過三層液電解精煉法可由粗鋁獲得高純鋁(裝置如圖所示)。

①該裝置工作時,電極A作______極。
②熔融粗鋁時加入銅的作用是______。
【答案】 Al2O3+6H+=2Al3++3H2O 生成的CaSO4覆蓋在固體反應物表面,阻止鐵、鋁氧化物的溶解 Fe3+完全沉淀與Al3+開始沉淀的pH相近 增大FeSO4溶液濃度,有利于吸收NO的平衡向正反應方向移動或增大氧氣含量,有利于NO與O2、H2O反應轉化為HNO3等被吸收或減緩通入氣體的速率,增大氣液接觸時間 C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O 陰 增大陽極熔融物的密度
6Fe2++ 6N2↑+ 6CO2↑+6H2O 陰 增大陽極熔融物的密度
【解析】(1)①“酸浸”時,粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)中的Al2O3、Fe2O3、CaCO3被硫酸溶解,其中Al2O3發生反應的離子方程式為Al2O3+6H+=2Al3++3H2O,故答案為:Al2O3+6H+=2Al3++3H2O;
②硫酸鈣微溶于水。當硫酸質量分數大于50%,生成的硫酸鈣覆蓋在固體反應物表面,阻止鐵、鋁氧化物的溶解,使得金屬氧化物浸出率明顯下降,故答案為:生成的CaSO4覆蓋在固體反應物表面,阻止鐵、鋁氧化物的溶解;
(2)根據金屬離子以氫氧化物沉淀時離子濃度隨pH變化圖像,Fe3+完全沉淀與Al3+開始沉淀的pH相近,導致浸出液不經還原直接與氨水混合,鋁、鐵元素分離效果較差,故答案為:Fe3+完全沉淀與Al3+開始沉淀的pH相近;
(3)①FeSO4溶液吸收NO的原理為Fe2++2NO![]() [Fe(NO)2]2+,為提高煙氣中NO 的吸收率,可采取的措施有增大FeSO4溶液濃度,有利于吸收NO的平衡向正反應方向移動,根據煙氣中O2的體積分數對NO吸收率的影響圖像,可以增大氧氣含量,有利于NO與O2、H2O反應轉化為HNO3等被吸收,也可以減緩通入氣體的速率,增大氣液接觸時間,故答案為:增大FeSO4溶液濃度,有利于吸收NO的平衡向正反應方向移動或增大氧氣含量,有利于NO與O2、H2O反應轉化為HNO3等被吸收或減緩通入氣體的速率,增大氣液接觸時間;
[Fe(NO)2]2+,為提高煙氣中NO 的吸收率,可采取的措施有增大FeSO4溶液濃度,有利于吸收NO的平衡向正反應方向移動,根據煙氣中O2的體積分數對NO吸收率的影響圖像,可以增大氧氣含量,有利于NO與O2、H2O反應轉化為HNO3等被吸收,也可以減緩通入氣體的速率,增大氣液接觸時間,故答案為:增大FeSO4溶液濃度,有利于吸收NO的平衡向正反應方向移動或增大氧氣含量,有利于NO與O2、H2O反應轉化為HNO3等被吸收或減緩通入氣體的速率,增大氣液接觸時間;
②“再生”過程中,[Fe(NO)2]2+在微生物的作用下與C6H12O6發生反應生成二氧化碳和氮氣,反應的離子方程式為C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案為:C6H12O6+6[Fe(NO)2]2+
6Fe2++ 6N2↑+ 6CO2↑+6H2O,故答案為:C6H12O6+6[Fe(NO)2]2+![]() 6Fe2++ 6N2↑+ 6CO2↑+6H2O;
6Fe2++ 6N2↑+ 6CO2↑+6H2O;
(4)①根據電解目的,要將粗鋁通過電解得到高純鋁,需要將粗鋁作陽極,高純鋁作陰極,該裝置工作時,電極A作陰極,故答案為:陰;
②熔融粗鋁時加入銅可以增大陽極熔融物的密度,使之在最下層,故答案為:增大陽極熔融物的密度。


科目:高中化學 來源: 題型:
【題目】由P、S、Cl、Ni等元素組成的新型材料有著廣泛的用途,回答下列問題。
(1)基態 Cl原子核外電子占有的原子軌道數為______個,P、S、Cl的第一電離能由大到小順序為______。
(2)SCl2分子中的中心原子雜化軌道類型是______,該分子構型為______。
(3)PH4Cl的電子式為______,Ni與CO能形成配合物Ni(CO)4,該分子中σ鍵與π鍵個數比為______。
(4)已知MgO與NiO的晶體結構(如圖1)相同,其中Mg2+和Ni2+的離子半徑分別為66pm和69pm。則熔點:MgO______NiO(填“>”、“<”或“=”),理由是______。
(5)若NiO晶胞中離子坐標參數A為(0,0,0),B為(1,1,0),則C離子坐標參數為______。
(6)一定溫度下,NiO晶體可以自發地分散并形成“單分子層”,可以認為O2-作密置單層排列,Ni2+填充其中(如圖2),已知O2-的半徑為a m,每平方米面積上分散的該晶體的質量為______g。(用a、NA表示)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分別通入乙烯加入苯,都能觀察到溴水褪色現象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2兩種同分異構體
C—CH=CH2兩種同分異構體
D. 芳香烴![]() 和
和![]() 的一氯代物都只有2種
的一氯代物都只有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組利用如圖裝置進行鐵與水蒸氣反應的實驗,并檢驗產物的性質,請回答下列問題:

(1)A裝置的作用是____________,燒瓶底部放碎瓷片的作用是_________________________。
(2)裝置B中發生反應的化學方程式是____________________________________,該反應中氧化劑是__________,氧化產物是__________________。
(3)D的作用是__________________________________。
(4)E中的實驗現象是____________________________。
(5)A、B兩個裝置中應先點燃________________處的酒精(噴)燈,點燃E處酒精燈之前應進行的操作是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學學科中的平衡理論主要包括: 化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理。請回答下列問題:

(1)在體積為3L 的密閉容器中,CO 與H2 在一定條件下反應生成甲醇(圖2):CO(g)+2H2(g)![]() CH3OH(g)。升高溫度,K值____(填“增大”、“減小”或“不變”)。
CH3OH(g)。升高溫度,K值____(填“增大”、“減小”或“不變”)。
(2) 常溫下,取pH=2的鹽酸和醋酸溶液各100mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH 變化如圖1所示。則表示醋酸溶液pH 變化的曲線是_______ (填“A”或“B”)。設鹽酸中加入的Zn質量為m1,醋酸溶液中加入的Zn質量為m2。則m1____m2 (選填“<”、“=”、“>”)。
(3)生活中明礬常作凈水劑,其凈水的原理是_______ (用離子方程式表示)。
(4)含Cr2O72-的廢水毒性較大,某工廠廢水中含5.0×10-3mol/L 的Cr2O72-。為了使廢水的排放達標,進行如下處理:
![]()
常溫下若處理后的廢水中c(Cr3+)=6.0×10-7mol/L,則處理后的廢水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸錳可用于制造鈉離子電池的負極材料。可用如下反應制得乙酸錳:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基態核外電子排布式為______。
(2)NO中氮原子軌道的雜化類型是______。
(3)與HNO2互為等電子體的一種陰離子的化學式為______。
(4)配合物[Mn(CH3OH)6]2+中提供孤對電子的原子是______。
(5)CH3COOH能與H2O任意比混溶的原因,除它們都是極性分子外還有______。
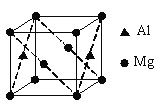
(6)鎂鋁合金經過高溫淬火獲得一種儲鈉材料,其晶胞為立方結構(如圖所示),圖中原子位于頂點或面心。該晶體中每個鋁原子周圍距離最近的鎂原子數目為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~G是幾種烴的分子球棍模型(如圖),據此回答下列問題:


(1)常溫下含碳量最高的氣態烴是________(填字母)。
(2)E的一氯取代物同分異構有_______種。
(3)一鹵代物種類最多的是________(填寫字母)。
(4)能夠與Br2發生加成反應的兩種氣態烴是________(填寫字母)。
(5)寫出C的加聚反應的化學方程式:______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com