
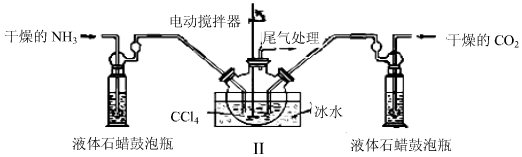
分析 (1)由題目信息可知,氨氣與二氧化碳反應生成NH2COONH4;氨基甲酸胺易分解,圖中反應裝置用冰水冷卻,防止氨基甲酸胺分解,說明制備氨基甲酸胺的為放熱反應;
(2)根據液體石蠟瓶鼓泡瓶中氣泡控制氣體流速和原料氣體的配比;
(3)由氨基甲酸胺小晶體懸浮在四氧化碳中,可以采取過濾方法分離;
(4)氨基甲酸胺極易水解,產物是碳酸氫銨和一種弱堿,該弱堿為NH3•H2O;
(5)①利用碳酸氫根與氯化鋇沒有沉淀生成,而與氫氧化鈣溶液有沉淀生成可驗證氨基甲酸銨的水解產物有HCO3-;
②生成的沉淀為碳酸鋇,根據碳原子守恒、混合物總質量列方程各自物質的量,再計算氨基甲酸胺的質量,進而計算其物質的量分數.
解答 解:(1)由題目信息可知,氨氣與二氧化碳反應生成NH2COONH4,反應方程式為:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,圖中反應裝置用冰水冷卻,防止氨基甲酸胺分解,說明制備氨基甲酸胺的為放熱反應,
故答案為:2NH3(g)+CO2(g)?NH2COONH4;放熱;
(2)可以根據液體石蠟瓶鼓泡瓶中氣泡,控制氣體流速和調節NH3與CO2通入比例,
故答案為:通過觀察氣泡,控制氣體流速和調節NH3與CO2通入比例;
(3)由氨基甲酸胺小晶體懸浮在四氧化碳中,可以采取過濾方法分離,
故答案為:過濾;
(4)氨基甲酸胺極易水解,產物是碳酸氫銨和一種弱堿,該弱堿為NH3•H2O,反應方程式為:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,
故答案為:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
(5)①利用碳酸氫根與氯化鋇沒有沉淀生成,而與氫氧化鈣溶液有沉淀生成可驗證氨基甲酸銨的水解產物有HCO3-,實驗設計方案為:取少量固體樣品于試管中,加入蒸餾水至固體溶解,得到無色溶液,加入過量的BaCl2溶液,靜置,取上層清液于另一試管,向試管中繼續加入少量澄清石灰水.溶液變渾濁,說明氨基甲酸銨水解產物有碳酸氫根,
故答案為:加入過量的BaCl2溶液,靜置,取上層清液于另一試管,向試管中繼續加入少量澄清石灰水.溶液變渾濁,說明氨基甲酸銨水解產物有碳酸氫根;
②生成的沉淀為碳酸鋇,其物質的量為:$\frac{1.97g}{197g/mol}$=0.01mol,
氨基甲酸銨物質的量為x,碳酸氫銨物質的量為y,
由碳元素守恒可知:x+y=0.01
由質量可得:78x+79y=0.782
解得x=0.008mol,y=0.002mol,
則制得的樣品中氨基甲酸胺的物質的量分數為:$\frac{0.008mol}{0.01mol}$×100=80.0%,
故答案為:80.0%.
點評 本題考查物質制備實驗、化學反應速率影響因素、物質含量測定、化學與技術等,題目難度中等,把握反應原理為解答的關鍵,側重分析與實驗能力的考查,綜合性較強.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉的最簡式:CH2O | B. | 鄰羥基苯甲酸的結構簡式: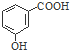 | ||
| C. | 2-乙基-1,3-丁二烯的鍵線式: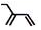 | D. | 苯分子球棍模型: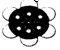 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
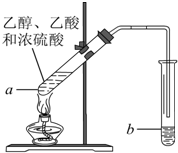 紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了有香味的酯.在實驗室也可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題.
紅葡萄酒密封儲存時間越長,質量越好,原因之一是儲存過程中生成了有香味的酯.在實驗室也可以用如圖所示的裝置制取乙酸乙酯,請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
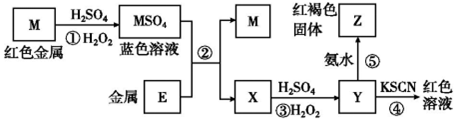
| A. | 在反應①中硫酸既表現了酸性、又表現了氧化性 | |
| B. | 我國是世界上最早使用反應②冶煉金屬M的國家 | |
| C. | 在③反應中若不加稀硫酸可能看到紅褐色沉淀 | |
| D. | 紅褐色固體Z不能溶于氫氧化鈉溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com