
分析 (1)根據n=$\frac{m}{M}$計算出硫酸的物質的量,根據m=nM計算出水的質量;
(2)根據n=$\frac{m}{M}$計算出鋁離子的物質的量,然后結合硫酸鋁的化學式計算出硫酸鋁、硫酸根離子的物質的量,最高價N=nNA計算出含有硫酸根離子的數目;
(3)該氧化物的化學式為RO,根據質量不會計算出消耗O原子的物質的量,然后可得出該金屬的物質的量,最高價M=$\frac{m}{n}$計算出其摩爾質量,從而可知其相對原子量;
(4)根據n=$\frac{N}{{N}_{A}}$計算出二氧化碳的物質的量,最高價m=nM計算出其質量,最高價n=$\frac{m}{M}$計算出需要氫氣的質量;根據二氧化碳的物質的量計算出含有O的物質的量,然后計算出需要二氧化硫的物質的量,再根據m=nM計算出二氧化硫的質量.
解答 解:(1)9.8gH2SO4的物質的量為:$\frac{9.8g}{98g/mol}$=0.1mol;2.0molH2O的質量是:18g/mol×2.0mol=36g,
故答案為:0.1mol;36g;
(2)5.gAl3+5的物質的量為:$\frac{5.4g}{27g/mol}$=0.2mol,該硫酸鋁的物質的量為:0.2mol×$\frac{1}{2}$=0.1mol,其中含SO42- 的物質的量為:0.1mol×3=0.3mol,含有硫酸根離子的數目為0.3NA,
故答案為:0.1mol;0.3NA;
(3)某二價金屬1.6g在氧氣中完全燃燒生成2g氧化物,設該氧化物的化學式為RO,反應消耗O原子的質量為:2g-1.6g=0.4g,消耗O的物質的量為:$\frac{0.4g}{16g/mol}$=$\frac{1}{40}$mol,該金屬原子的摩爾質量為:$\frac{1.6g}{\frac{1}{40}mol}$64g/mol,其相對原子量為64,
故答案為:64;
(4)6.02×1023個CO2的物質的量為:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,其質量為:44g/mol×1mol=44g,質量相等時需要氫氣的物質的量為:$\frac{44g}{2g/mol}$=22mol;1mol二氧化碳分子中含有2molO原子,含有氧原子相同時需要二氧化碳的物質的量為1mol,質量為:64g/mol×1mol=64g,
故答案為:22;64.
點評 本題考查了物質的量的計算,題目難度中等,明確物質的量與其它物理量之間的關系即可解答,試題培養了學生的化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| 混合物 | 試劑 | 分離方法 | |
| A | 苯(苯酚) | 溴水 | 過濾 |
| B | 甲烷(乙烯) | 溴水 | 洗氣 |
| C | 乙酸乙酯(乙酸) | 氫氧化鈉溶液 | 蒸餾 |
| D | 溴乙烷(乙醇) | 蒸餾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.9g水中含有的電子數為NA | |
| B. | 常溫常壓下,0.2 NA個NH3分子的質量為3.4g | |
| C. | 14.0g由C2H4和C3H6組成的混合氣體原子總數為3NA | |
| D. | 1 mol Na變為Na+時失去的電子數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知某市售“84消毒液”瓶體部分標簽如下圖所示,該“84 消毒液”通常稀釋100 倍(體積之比)后使用. 請回答下列問題:
已知某市售“84消毒液”瓶體部分標簽如下圖所示,該“84 消毒液”通常稀釋100 倍(體積之比)后使用. 請回答下列問題:
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,K值增大 | B. | K值越大,反應物轉化率越大 | ||
| C. | 加入催化劑不改變平衡常數K | D. | 平衡向右移動K值不一定改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑥ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
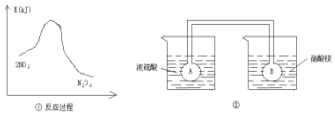 利用圖①中的信息,按圖②裝置鏈接的A、B瓶中已充有NO2氣體.B瓶中的氣體顏色比A瓶中的淺(填“深”或“淺”),其原因是2NO?N2O4△H<0,A瓶加熱,平衡左移顏色加深,B瓶降低溫度,平衡右移顏色變淺.
利用圖①中的信息,按圖②裝置鏈接的A、B瓶中已充有NO2氣體.B瓶中的氣體顏色比A瓶中的淺(填“深”或“淺”),其原因是2NO?N2O4△H<0,A瓶加熱,平衡左移顏色加深,B瓶降低溫度,平衡右移顏色變淺.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com