
【題目】烯烴在一定條件下發生氧化反應,碳碳雙鍵斷裂,如:R1CH═CHR2,被氧化為![]() 和
和![]() ;
; 被氧化為
被氧化為 和
和 ,由此推斷分子式為C5H10的烯烴的氧化產物有( )
,由此推斷分子式為C5H10的烯烴的氧化產物有( )
A.5種 B.6種 C.7種 D.8種
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增加。相關信息如下表所示,根據推斷回答下列問題:(答題時A、B、C、D、E、F用所對應的元素符號表示)
A | A原子核外電子有6種不同的運動狀態 |
B | B元素的第一電離能比同周期相鄰兩個元素都大 |
C | C原子在同周期原子中半徑最大(稀有氣體除外),其單質焰色為黃色 |
D | D原子最外層電子數等于電子層數 |
E | E的基態原子最外層電子排布式為3s23p2 |
F | F與C位于不同周期,F原子核外最外層電子數與C相同,其余各層電子均充滿 |
(1)F基態原子核外價電子排布式是________________
(2)A、B、E三種元素電負性由大到小排列順序為__________________
(3)B元素可形成多種單質,其中“只有一層原子厚”的物質,被公認為目前世界上已知的最薄、最堅硬、傳導電子速度最快的新型材料,該材料晶體結構如右圖所示,其原子的雜化類型為________________

(4)煤燃燒產生的煙氣中有B的氧化物,會引起嚴重的環境問題,因此,常用AH4催化還原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
寫出AH4和B2O4反應的熱化學方程式__________________
(5)D單質為面心立方晶體,其晶胞邊長a=0.405nm,用NA表示阿伏伽德羅常數,列式表示D單質的密度______g·cm-3(不必計算出結果)。
(6)繼A60后,科學家又合成了E60、B60, E60分子中每個E原子只跟相鄰的3個原子形成共價鍵,且每個E原子最外層都滿足8電子穩定結構,則E60分子中π鍵的數目為_______________
(7)F的單質和過氧化氫在稀硫酸中可反應,有人將這個反應設計成原電池,請寫出該原電池正極反應方程式_______________
(8)某學生所做的有關F元素的實驗流程如下圖:
F單質![]() 棕色的煙
棕色的煙![]() 綠色溶液
綠色溶液![]() 藍色沉淀
藍色沉淀![]() 藍色溶液
藍色溶液![]() 黑色沉淀
黑色沉淀
請書寫第⑤步反應的離子方程式:___________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會、生活密切相關。下列說法不正確的是 ( )
A. 金屬鈉可以保存在石蠟油中,并貼上如圖標志
B. 夏天雷雨過后空氣特別清新是因為空氣中產生了少量臭氧
C. 石油的裂解可以得到甲烷、乙烯、丙烯等重要化工原料
D. 煤中含有苯、甲苯和粗氨水,可通過干餾得到上述產品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種相鄰短周期主族元素的相對位置如表,元素X的原子核外電子數是元素M的2倍,Y的氧化物具有兩性。下列說法不正確的是
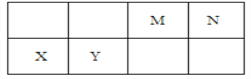
A. 基態Y原子中存在6種能量不同的電子
B. X位于第三周期IIA ,其單質可采用電解熔融其氯化物制備
C. 元素最高價氧化物的水化物中,酸性最強的是HNO3
D. 氣體分子(MN)2的電子式為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,針對表中用字母標出的元素,回答下列問題:
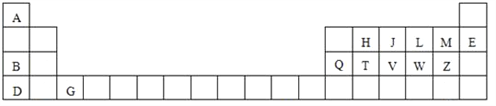
(1)原子半徑最大的元素是_______;在化合物中只有負價的元素是 _______;屬于副族元素是_______;適合作半導體材料的是_______,(只用表中的字母填寫)
(2)V在周期表中的位置第_______周期第_______族。.
(3)M原子基態電子排布式為___________________________________。
L原子基態電子排布圖為____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某物質(X)是有機合成中重要中間體,下列關于它的說法正確的是( )
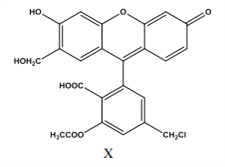
A. 1 mol X 與與足量的 NaOH 溶液反應, 最多消耗 6mol NaOH
B. 1 mol X 最多能與 10mol 氫氣反應,且生成物中無手性碳原子
C. 1mol X 與足量的濃溴水反應,最多消耗 2mol Br2
D. X 分子式為 C24H17O8Cl,是芳香族化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 三氯化碘(ICl3)在藥物合成中用途非常廣泛,其熔點:33℃,沸點:73℃。實驗室可用下圖所示裝置制取ICl3 :

(1)儀器a 的名稱是 。
(2)制備氯氣選用的藥品為漂白粉固體[主要成分為Ca(ClO)2]和濃鹽酸,有關反應的化學方程式為 。
(3)裝置B(吸濾瓶)即可用于除雜,也是安全瓶,能監側實驗進行時裝置C中是否發生了堵塞。請描述發生堵塞時B中現象 。
(4)試劑X為 。
(5)氯氣與單質碘需在溫度稍低于70℃下反應,則裝置D適宜的加熱方式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醫療上綠礬(FeSO47H2O)是治療缺鐵性貧血的特效藥。某化學興趣小組對綠礬進行了如下的探究:

Ⅰ.【制備產品】該小組由廢鐵屑(含少量油污、氧化銅、氧化鐵等雜質),用如圖所示裝置制備FeSO47H2O晶體,步驟如下:
(1)預處理:先將廢鐵屑加入到飽和Na2CO3溶液中洗滌,目的是_________________,然后將廢鐵屑用水洗滌2~3遍。
(2)將洗滌后的廢鐵屑加入到圓底燒瓶中。加稀硫酸進行反應前要持續通入N2,通入N2的作用是____________________。
(3)加入足量稀硫酸,控制溫度50℃~80℃之間,充分反應后,圓底燒瓶中剩余的固體為_________。
(4)獲取產品:先向步驟(3)中反應后的混合物中加入少許蒸餾水,趁熱過濾。將濾液____________,濾出晶體,用少量冰水洗滌2~3次,再用濾紙將晶體吸干,密閉保存產品。
Ⅱ.【測定FeSO47H2O含量】
(1)稱取上述樣品10.0g,溶于適量的稀硫酸中,配成100mL溶液,需要的儀器除天平、玻璃棒、燒杯、量筒外,還需要的儀器有(填儀器名稱)___________、_____________。
(2)用移液管準確移取25.00mL該液體于錐形瓶中,用0.1000mol/LKMnO4標準溶液滴定,則滴定終點的判斷方法是__________________________________。
(3)用同樣的方法滴定3次,平均消耗10.00mL標準液,該樣品中FeSO47H2O的質量分數為_________。(已知Mr(FeSO47H2O)=278)。
(4)若測量結果偏小,可能是在用標準溶液滴定時由下列___(填序號)操作導致。
A.錐形瓶蒸餾水洗后未干燥,也未用待測液潤洗
B.酸式滴定管未用標準液潤洗就直接用于盛裝待測液
C.滴定終點時,俯視讀數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com