
【題目】氮及其化合物在生活及工業生產中有著重要應用。請回答以下問題:
(1)如圖是N2(g)、H2(g)與NH3(g)之間轉化的能量關系圖,則:
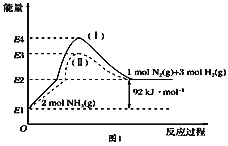
①N2(g)與H2(g)反應生成NH3(g)的熱化學方程式為___________________.
②過程(Ⅰ)和過程(Ⅱ)的反應熱________(填“相同”或“不同”).
③某溫度下,在1 L恒溫恒容容器中充入1molN2和3 mol H2進行上述反應,10 min達到平衡,此時容器內壓強變為原來的7/8.
a.該過程的平衡常數的表達式為____________.
b.N2的平衡轉化率為________.
c.此時若保持容器溫度和體積不變,向其中再加入2.25 molN2和0.5 mol NH3,則平衡________(填“正向”“逆向”或“不”)移動.
(2)用NH3可以消除氮氧化物的污染,已知:
反應Ⅰ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常數為K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常數為K1
反應Ⅱ:N2(g)+O2(g)![]() 2NO(g) ΔH2=b kJ·mol-1 平衡常數為K2
2NO(g) ΔH2=b kJ·mol-1 平衡常數為K2
反應Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常數為K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常數為K3
則反應Ⅱ中的b=_____(用含a、c的代數式表示),K3=_____(用K1和K2表示).反應Ⅲ中的ΔS______(填“>”“<”或“=”)0.
(3)在恒容的密閉器中,充入一定量的NH3和NO進行上述反應Ⅲ,測得不同溫度下反應體系中NH3的轉化率(α)與壓強p的關系如圖所示:
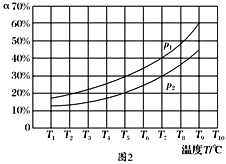
①分析得p1________p2.(填“>”“<”或“=”)
②下列敘述中,不能作為判斷反應Ⅲ已經達到平衡狀態的標志的是________(填序號).
a.N2的濃度不再改變 b.斷裂6 mol N—H鍵的同時,有6 mol H—O鍵形成
c.容器中壓強不再變化 d.混合氣體的密度保持不變
【答案】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1 相同 K=c2(NH3)/[c(N2)c3(H2)] 25% 不 (a-c)/3
2NH3(g) ΔH=-92 kJ·mol-1 相同 K=c2(NH3)/[c(N2)c3(H2)] 25% 不 (a-c)/3 ![]() > < bd
> < bd
【解析】
(1)①據圖可知2molNH3分解得到1molN2和3molH2,吸收92kJ/mol的熱量,因而N2(g)與H2(g)反應生成NH3(g)的熱化學方程式為N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
②根據蓋斯定律,反應熱只與起始狀態及終了狀態有關,與過程無關,這兩個過程起始狀態和終了狀態相同,因而反應熱相同。
③可以根據三段式去求解,設轉化xmol/LN2:
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起 1 3 0
轉 x 3x 2x
平 1-x 3-3x 2x
根據此時容器內壓強變為原來的7/8,可列式得![]() ,則x=0.25mol/L。
,則x=0.25mol/L。
a. K= ![]() ;
;
b. N2的平衡轉化率為0.25/1×100%=25%;
c. 平衡時c(N2)=0.75mol/L,c(H2)=2.25mol/L,c(NH3)=0.5mol/L,K=![]() =0.029,向其中再加入2.25 molN2和0.5 mol NH3,則c(N2)=3mol/L,c(H2)=2.25mol/L,c(NH3)=1mol/L,Q=
=0.029,向其中再加入2.25 molN2和0.5 mol NH3,則c(N2)=3mol/L,c(H2)=2.25mol/L,c(NH3)=1mol/L,Q= ![]() =0.029,因而Q=K,平衡不移動。
=0.029,因而Q=K,平衡不移動。
(2)根據蓋斯定律,設反應Ⅰ、Ⅱ、Ⅲ分別為A、B、C,則B=(A-C)/3,因而b=(a-c)/3,由于c=a-3b,所以可知K3=K1/K23,根據4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)可知該反應各物質均為氣體,且氣體體積增大,因而混亂度變大,故ΔS>0。
5N2(g)+6H2O(g)可知該反應各物質均為氣體,且氣體體積增大,因而混亂度變大,故ΔS>0。
(3)根據4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)可知該反應的氣體計量數在反應前后增大,因而保持溫度不變,NH3的轉化率(α)越大,說明壓強越小,因而p1<p2。a.N2的濃度不再改變,說明各組分濃度都不變,因而可以作為判斷平衡的標志,正確;b.斷裂6 mol N—H鍵的同時,有6 mol H—O鍵形成,根據反應特點,兩者都表示正反應速率,因而錯誤;c.由于反應前后氣體計量數變化,當容器中壓強不再變化可以判斷平衡,正確;d.混合氣體的密度ρ=m/V,由于各組分都是氣體,反應前后混合氣體總質量不變,又容器恒定,體積不變,因而密度始終是個定值,錯誤。故答案選bd。
5N2(g)+6H2O(g)可知該反應的氣體計量數在反應前后增大,因而保持溫度不變,NH3的轉化率(α)越大,說明壓強越小,因而p1<p2。a.N2的濃度不再改變,說明各組分濃度都不變,因而可以作為判斷平衡的標志,正確;b.斷裂6 mol N—H鍵的同時,有6 mol H—O鍵形成,根據反應特點,兩者都表示正反應速率,因而錯誤;c.由于反應前后氣體計量數變化,當容器中壓強不再變化可以判斷平衡,正確;d.混合氣體的密度ρ=m/V,由于各組分都是氣體,反應前后混合氣體總質量不變,又容器恒定,體積不變,因而密度始終是個定值,錯誤。故答案選bd。


 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:
【題目】研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)一定條件下,將2molNO與2molO2置于恒容密閉容器中發生如下反應:2NO(g)+O2(g)![]() 2NO2(g),下列各項能說明反應達到平衡狀態的是_____________。
2NO2(g),下列各項能說明反應達到平衡狀態的是_____________。
A.體系壓強保持不變
B.混合氣體顏色保持不變
C.NO和O2的物質的量之比保持不變
D.每消耗1 molO2同時生成2 molNO
(2)CO可用于合成甲醇,一定溫度下,向體積為2L的密閉容器中加入CO和H2,發生反應CO(g)+2H2(g)![]() CH3OH(g),達平衡后測得各組分濃度:
CH3OH(g),達平衡后測得各組分濃度:
物質 | CO | H2 | CH3OH |
濃度(mol/L) | 0.9 | 1.0 | 0.6 |
回答下列問題:
①混合氣體的平均相對分子質量=_________________。
②平衡常數K=__________________。
③若將容器體積壓縮為1L,不經計算,預測新平衡中c(H2)的取值范圍是__________。
④若保持體積不變,再充入0.6molCO和0.4molCH3OH,此時v正______v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物甲和A互為同分異構體,經測定它們的相對分子質量小于100;將1mol甲在O2中充分燃燒得到等物質的量的CO2和H2O (g) ,同時消耗112L O2(標準狀況);在酸性條件下將1mol甲完全水解可以生成1mol乙和1mol丙;而且在一定條件下,丙可以被連續氧化成為乙。
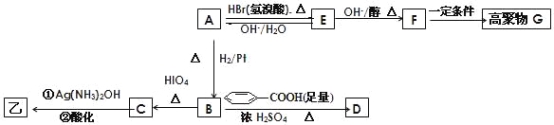
經紅外光譜測定,在甲和A的結構中都存在C=O雙鍵和C-O單鍵,B在HIO4存在并加熱時只生成一種產物C,下列為各相關反應的信息和轉化關系:
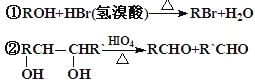
⑴ 請確定并寫出甲的分子式_______;與甲屬同類物質的同分異構體共有____種(包含甲)。
⑵ E→F 的反應類型為_________反應;
⑶ A的結構簡式為_________;G 的結構簡式為_________;
⑷ B→D的反應化學方程式為_______________________________;
⑸ 寫出C在條件①下進行反應的化學方程式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學--有機化學基礎】有機物G(![]() )是一種調香香精,可用作抗氧劑,工業上合成它的路線圖之一如下:
)是一種調香香精,可用作抗氧劑,工業上合成它的路線圖之一如下:

(1)A中官能團的名稱是_____,B→C的反應類型為_________。
(2)G分子中一定共平面的碳原子有______個。
(3)反應F→G中消耗的F與CH3MgBr的物質的量之比為______,B在濃硫酸存在下加熱可通過一步反應得到E物質,但合成不采用此方法,其原因是__________。
(4)C→D的化學方程式為_______________。
(5)E有多種同分異構體,其中滿足下列條件的同分異構體有_____種,寫出核磁共振氫譜有4個吸收蜂的物質的結構簡式:_______。
①含有一個六元環 ②1mol同分異構體與足量銀氨溶液發生銀鏡反應生成4 mol Ag
(6)已知A轉化為B的原理與F轉化為G的相似,請設計以A為起始原料(其他試劑任選)制備![]() 的合成路線______________。
的合成路線______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】雙羥基鋁碳酸鈉是醫療上常用的一種抑酸劑,其化學式是NaAl(OH)2CO![]() 。關于該物質的說法正確的是( )
。關于該物質的說法正確的是( )
A. 該物質屬于兩性氫氧化物
B. 該物質是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 該藥劑不適合于胃潰瘍患者服用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D均為中學化學中常見的物質,它們之間轉化關系如圖(部分產物已略去):
A![]() B
B![]() C
C
試回答:
(1)若D是具有氧化性的單質,則屬于主族的金屬A為___________(填元素符號)
(2)若D是金屬,C溶液在儲存時應加入少量金屬D,其理由是(用必要的文字和離子方程式表示)______
(3)若A、B、C為含同一種金屬元素的無機化合物,且三種物質中有一種是白色不溶物。在溶液中A和C反應生成B。請寫出B轉化為C的所有可能的離子力程式_________、_________
(4)某一離子反應體系有反應物和產物共以下六種:MnO4-、H+、O2、H2O、H2O2、Mn2+。
①寫出該氧化還原反應的離子方程式_______
②溶液隨著酸性的增強氧化性不斷增強,應選擇_________(選填“稀硫酸”或“濃鹽酸”)進行KMnO4溶液的酸化。
③如反應轉移了0.6mo1電子,則產生的氣體在標準狀況下體積為__________
(5)一份溶液中可能含有K+、Al3+、Mg2+、Fe2+、 H+、NH4+、Cl-、HCO3-、ClO-、AlO2-等離子中的若干種。為了確定溶液的組成,進行了如下操作:
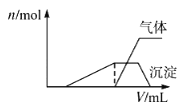
往該溶液中逐滴加入NaOH溶液并適當加熱,產生沉淀和氣體的物質的量(n)與加入NaOH溶液的體積關系如圖所示;則該溶液中一定存在的離子是_______,一定不存在的離子是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源開發、環境保護、資源利用等是當今社會的熱門話題。請根據所學化學知識回答下列問題:
(1)汽車上安裝催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1;
則尾氣轉化反應2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽車尾氣分析儀對CO的含量分析是以燃料電池為工作原理,其裝置如下圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質中自由移動。

下列說法中正確的是_____________(填字母序號)。
A.負極的電極反應式為:CO + O2-―2e-=CO2
B.工作時電子由電極a通過傳感器流向電極b
C.工作時電極b作正極,O2-由電極a通過固體介質向電極b遷移
D.傳感器中通過的電流越大,尾氣中CO的含量越高
(3)某硝酸廠利用甲醇處理廢水。在一定條件下,向廢水中加入CH3OH,將HNO3還原成N2。若該反應消耗32 g CH3OH轉移6 mol電子,則參加反應的還原劑和氧化劑的物質的量之比為______________。
(4)煤的間接液化是先轉化為CO和H2,再在催化劑作用下合成甲醇。若在一定溫度下,向1 L密閉容器中加入CO和H2,發生反應CO(g)+2H2(g)![]() CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:
CH3OH(g),經10 min反應達到平衡時測得各組分的濃度如下:
物 質 | CO | H2 | CH3OH |
濃度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
①該反應的平衡常數表達式為:K=_____________________。
②該時間內反應速率υ(H2)=_________________。
③平衡時CO的轉化率為_________________(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、Cl-、NO3-中的幾種,將此溶液分成兩等份。進行如下實驗:(AgCl式量為143.5,AgI式量為235)
①在一份溶液中加入足量NaOH,加熱,可收集到標準狀態下的氣體1.12L;
②在另一份溶液中加入足量Ba(NO3)2溶液,有白色沉淀產生,過濾得到沉淀2.33g;
③在②的濾液中加入足量AgNO3溶液,又有4.7g沉淀產生。
有關該溶液中離子種類(不考慮H+和OH-)的判斷正確的是
A.溶液中至少有2種陽離子
B.只能確定溶液中NH4+、SO42-是否存在
C.溶液中最多有4種陰離子
D.溶液中不可能同時存在K+和NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】春季復工、復學后,做好防護是控防新型冠狀病毒傳播的有效措施。下列說法正確的是
A.40%的甲醛溶液可做公共餐具消毒劑
B.生產醫用口罩的主要原料是聚丙烯(PP),分子式為(CH3CH=CH2)n。
C.95%的乙醇溶液、84消毒液可直接用作環境消毒劑
D.為減少直接吸入飛沫形成的氣溶膠感染病毒的幾率,就餐時人人間距至少應為1米
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com