
| 陽 | Fe | Mg | Al | Cr |
| 開始沉淀時的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全時的H | 3. | 11.1 | 8 | 9 (>9溶解) |

分析 含鉻污泥預處理后,酸浸溶解,用NaOH調節pH=8,Al3+、Fe3+完全沉淀,過濾除去Fe(OH)3、Al(OH)3;再調節pH>11,沉淀Mg2+,加入雙氧水,Cr3+能被雙氧水氧化為Na2CrO4溶液,蒸發濃縮,冷卻結晶,得到Na2CrO4晶體.
(1)依據溶液配制的步驟和過程分析所用到的儀器,主要儀器應有配制溶液的容量瓶和定容需要的膠頭滴管;配置一定物質的量濃度的溶液所需的玻璃儀器有:燒杯、玻璃棒、吸量管、容量瓶和膠頭滴管;
(2)用NaOH調節pH=8,Al3+、Fe3+完全沉淀;不能省略過濾Ⅱ,若不經過濾除去,當繼續加入NaOH時,Al(OH)3會溶解,引入雜質離子AlO2-;
(3)根據雙氧水的性質分析,雙氧水有強氧化性,能氧化還原性的物質,依據氧化還原反應電子守恒、原子守恒配平書寫離子方程式;
(4)①FeSO4標準溶液顯酸性,用酸式滴定管盛放;
②滴定時,左手控制活塞,右手震蕩錐形瓶,眼睛注視錐形瓶內顏色變化,滴定至終點時,記錄標準液的體積;
③根據滴定關系式計算:Na2CrO4~3FeSO4.
解答 解:含鉻污泥預處理后,酸浸溶解,用NaOH調節pH=8,Al3+、Fe3+完全沉淀,過濾除去Fe(OH)3、Al(OH)3;再調節pH>11,沉淀Mg2+,加入雙氧水,Cr3+能被雙氧水氧化為Na2CrO4溶液,蒸發濃縮,冷卻結晶,得到Na2CrO4晶體.
(1)配置一定物質的量濃度的溶液所需的玻璃儀器有:燒杯、玻璃棒、量筒、吸量管、容量瓶和膠頭滴管,
故答案為:量筒、250mL容量瓶、膠頭滴管;
(2)用NaOH調節pH=8,Al3+、Fe3+完全沉淀,故濾渣Ⅱ是Fe(OH)3、Al(OH)3;不能省略過濾Ⅱ,若不經過濾除去,當繼續加入NaOH時,Al(OH)3會溶解,引入雜質離子AlO2-;
故答案為:Fe(OH)3、Al(OH)3;不能,當pH=8時,Al3+已經完全轉化為沉淀,若不經過濾除去,當繼續加入NaOH時,Al(OH)3會溶解,引入雜質離子AlO2-;
(3)雙氧水有強氧化性,能氧化還原性的物質,Cr3+有還原性,Cr3+能被雙氧水氧化為高價離子,以便于與雜質離子分離,反應的離子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
故答案為:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
(4)①FeSO4標準溶液顯酸性,用酸式滴定管盛放;故答案為:酸式;
②滴定時,左手控制活塞,右手震蕩錐形瓶,眼睛注視錐形瓶內顏色變化,滴定至終點時,記錄標準液的體積;
故答案為:左手控制活塞,右手震蕩錐形瓶,眼睛注視錐形瓶內顏色變化,滴定至終點時,記錄標準液的體積;
③根據滴定關系式:Na2CrO4~3FeSO4
1 3
n 0.300mol/L×0.020L,解之得n=0.002mol
m(Na2CrO4)=0.002mol×162g/mol=0.324g
該產品中Na2CrO4的質量分數為$\frac{0.324g}{0.48g}$×100%=66.67%;
故答案為:66.67%.
點評 本題考查了離子方程式、化學方程式的書寫、物質的分離等知識點,注意會運用溶液的PH值對溶液中的離子進行分離,除雜的原則是除去雜質且不引進新的雜質,本題難度較大.


 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案科目:高中化學 來源: 題型:選擇題
| A. | 往FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | Fe(OH)2溶于稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | Fe2O3溶與足量的氫溴酸:Fe2O3+6H++2Br-═2Fe2++Br2+3H2O | |
| D. | HCl滴入NaAlO2溶液中:AlO2-+H++H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
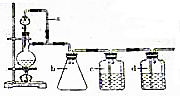 某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:CH2CH=CH2+CO+H2$→_{△}^{催化劑}$CH3CH3CH2CHO$→_{△}^{H_{2}催化劑}$CH3CH2CH2CH2OH.
某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:CH2CH=CH2+CO+H2$→_{△}^{催化劑}$CH3CH3CH2CHO$→_{△}^{H_{2}催化劑}$CH3CH2CH2CH2OH.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用以下實驗器材(規格和數量不限):燒杯、玻璃棒、膠頭滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的實驗 | |
| B. | 制備硫酸亞鐵晶體時,最后在蒸發皿中蒸發濃縮溶液時,只需小火加熱至溶液被全部蒸干 | |
| C. | 向兩支盛有KI3溶液的試管中分別加入淀粉和硝酸銀溶液,前者溶液變藍后者產生黃色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科學家在研究物質微觀結構的過程中先后使用了光學顯微鏡、電子顯微鏡、掃描隧道顯微鏡等觀測儀器 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
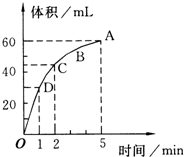 加入0.1mol的MnO2粉末于50mL過氧化氫的溶液中,在標準狀況下放出氣體的體積和時間的關系如圖所示(5分鐘反應完成),回答下列問題:
加入0.1mol的MnO2粉末于50mL過氧化氫的溶液中,在標準狀況下放出氣體的體積和時間的關系如圖所示(5分鐘反應完成),回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醋酸跟氫氧化鈉溶液反應:CH3COOH+OH-→CH3COO-+H2O | |
| B. | 鐵跟稀鹽酸反應:Fe+2H+→Fe2++H2↑ | |
| C. | 在硫氫化鈉溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ | |
| D. | 碳酸鈣溶于鹽酸中:CaCO3+2H+→Ca2++H2O+CO2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com