
分析 (1)①熱化學方程式N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1的含義是:當1mol氮氣和3mol氫氣完全反應生成2mol氨氣時,反應放熱92.4KJ;
②根據化學平衡狀態的特征解答,當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
(2)根據氨水電離生成等量的銨根離子和氫氧根離子,求出平衡時各離子的濃度,在利用電離平衡常數的表達式計算出NH3•H2O的電離平衡常數;
(3)根據Ksp[Al(OH)3]=1.0×10-33求出氫氧根離子濃度.
解答 解:(1)①熱化學方程式為N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol表示1mol氮氣(g)與3mol氫氣(g)生成2mol氨氣(g)反應的熱量為92.4kJ,由于該反應是可逆反應,加入1molN2和3molH2不可能完全反應,所以放出的熱量總是小于92.4kJ,故答案為:小于;
②A、NH3生成的速率與NH3分解的速率相等,達到了平衡狀態,故A正確;
B、混合氣體的反應速率$\frac{2}{3}$v正(NH3)=v逆(H2),不能說明正逆反應速率相等,不一定達平衡狀態,故B錯誤;
C、氣體的總質量不變,體積不變,所以混合氣體的密度不發生改變,該狀態不一定達平衡狀態,故C錯誤;
D、單位時間內消耗a mol N2,同時生成2a mol NH3,不能說明正逆反應速率相等,不一定達平衡狀態,故D錯誤;
故選A;
(2)氨水溶液PH=11,則c(H+)═10-11 mol•L-1,c(0H-)═10-3mol•L-1,
NH3•H2O?NH4++OH-
起始(mol•L-1) 0.1 0 0
反應(mol•L-1)-)10-3 10-3 10-3
平衡(mol•L-1) 0.1 10-3 10-3
NH3•H2O的電離平衡常數為:$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=1.0×10-5;
向此溶液中加入少量的氯化銨固體,溶液中銨離子濃度增大,氨水的電離程度減小,所以氫氧根離子濃度減小,此時銨根離子和氫氧根離子濃度的比值將增大,
故答案為:10-5; 增大;
(3)0.001mol/LAlCl3溶液中鋁離子濃度為0.001mol/L,帶人Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3可得:c(OH-)=1.0×10-10mol/L,常溫下,氫離子濃度為:1.0×10-4mol/L,溶液pH=4,
故答案為:4.
點評 本題考查了化學平衡狀態判斷、可逆反應特點、化學平衡常數的計算等知識,本題難度中等,試題涉及的知識點較多,注意掌握化學平衡狀態的判斷方法、化學反應的可能性,電離平衡常數的計算方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 用CaSO4代替O2與燃料CO反應,既可提高燃燒效率,又能得到高純CO2,是一種高效、清潔、經濟的新型燃燒技術.反應①為主反應,反應②和③為副反應.
用CaSO4代替O2與燃料CO反應,既可提高燃燒效率,又能得到高純CO2,是一種高效、清潔、經濟的新型燃燒技術.反應①為主反應,反應②和③為副反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若X的反應速率為0.2 mol•L-1•s-1,則Z的反應速率為0.3 mol•L-1•s-1 | |
| B. | 若向容器中充入氦氣,壓強增大,Y的轉化率提高 | |
| C. | 升高溫度,正反應速率減小,平衡向逆反應方向移動 | |
| D. | 開始充入容器中的X、Y物質的量之比為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 (R、R′代表烴基)
(R、R′代表烴基)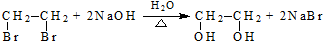 .
. .
.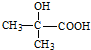 .
. .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com