
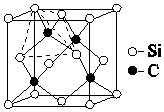
 C和Si元素在化學中占有極其重要的地位:
C和Si元素在化學中占有極其重要的地位:分析 (1)Si原子核外共14個電子,按照能量最低原則書寫電子排布式;元素周期表中主族元素越靠右、越靠上電負性越大,F的電負性最大(為4.0);
(2)CO2分子為直線形結構,可知碳原子采取sp雜化方式,原子數目相等、價電子總數也相等的微粒互為等電子體;
(3)Si原子比C原子半徑大,Si、O原子間距離較大;
(4)根據原子晶體的硬度大;每個碳原子連接4個硅原子,每個硅原子又連接其它3個碳原子,據此判斷每個C原子周圍最近的C原子數目;該晶胞中C原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子個數為4,根據ρ=$\frac{m}{V}$計算其密度.
解答 解:(1)Si是14號元素,Si原子核外共14個電子,按照能量最低原則電子先填入能量最低的1s軌道,填滿后再依次填入能量較高的軌道;其電子排布式為:1s22s22p63s23p2;從電負性的角度分析,O和C位于同一周期,非金屬性O強于C;C和Si為與同一主族,C的非金屬性強于Si,故由強到弱為O>C>Si,
故答案為:1s22s22p63s23p2; O>C>Si;
(2)CO2分子為直線形結構,可知碳原子采取sp雜化方式,原子數目相等、價電子總數也相等的微粒互為等電子體,和CO2 互為等電子體的氧化物是N2O,
故答案為:直線形;sp;N2O;
(3)CO2中C與O原子間形成σ鍵和π鍵,SiO2中Si與O原子間不形成上述π鍵,是因Si原子比C原子半徑大,Si、O原子間距離較大,P-P軌道肩并肩重疊程度較小,不能形成上述穩定的π鍵,故答案為:Si原子比C原子半徑大,Si、O原子間距離較大,P-P軌道肩并肩重疊程度較小,不能形成上述穩定的π鍵;
(4)金剛砂(SiC)的硬度為9.5,屬于原子晶體;每個碳原子連接4個硅原子,每個硅原子又連接其它3個碳原子,所以每個碳原子周圍最近的碳原子數目為3×4=12;該晶胞中C原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子個數為4,晶胞邊長=a×10-10cm,體積V=(a×10-10cm)3,ρ=$\frac{m}{V}$=$\frac{\frac{40×4}{N{\;}_{A}}}{(a×10{\;}^{-10})^{3}}$g•cm3=$\frac{1.6×10{\;}^{32}}{N{\;}_{A}}$g•cm3;
故答案為:原子晶體;12;$\frac{1.6×10{\;}^{32}}{N{\;}_{A}}$.
點評 本題考查位置結構性質的相互關系應用,為高頻考點和常見題型,側重于學生的分析能力的考查,涉及晶胞計算、原子雜化判斷、原子核外電子排布式的書寫等知識點,難點是晶胞計算,題目難度中等,正確推斷元素的種類為解答該題的關鍵,注意原子結構和元素周期表的關系.


 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:解答題
 硫-碘循環分解水制氫主要涉及下列反應:
硫-碘循環分解水制氫主要涉及下列反應:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等量的硫蒸氣和硫固體在氧氣中分別完全燃燒,放出熱量一樣多 | |
| B. | 需要加熱才能發生的反應一定是吸熱反應 | |
| C. | 在101kpa時,2gH2完全燃燒,生成液態水,放出285.8kJ熱量,則氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol | |
| D. | 在強酸強堿稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若將含1molNaOH的溶液和含0.5molH2SO4的濃硫酸混合,放出的熱量大于57.3 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
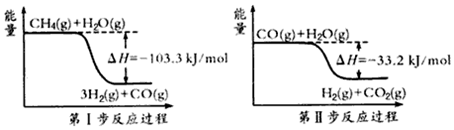
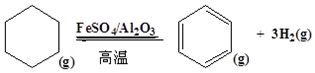
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Fe2+ | Fe3+ | Cu2+ | |
| 開始沉淀時pH | |||
| 完全沉淀時pH | 8 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL2mol/LMgCl2溶液 | B. | 1000mL2.5mol/LNaCl溶液 | ||
| C. | 300mL5mol/LFeCl3溶液 | D. | 250mL lmol/L AlCl3溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com