
【題目】(1)在淀粉碘化鉀溶液中通入少量氯氣,立即會看到溶液變藍色,反應的離子方程式是_______________.
(2)在碘和淀粉形成的藍色溶液中通入SO2氣體,發現藍色逐漸消失,反應的離子方程式是_______________.
(3)對比(1)和(2)實驗所得的結果,將Cl-、I-、SO2按還原性由強到弱順序排列為_______________.
(4)KMnO4的氧化性比MnO2強得多,實驗室也可以用KMnO4固體和濃鹽酸反應制取氯氣,反應方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O.
①當有0.2mole-轉移時被氧化的HCl的質量是_______________;
②如果將20mL12molL-1的濃鹽酸與足量KMnO4充分反應,實際能收集到的氯氣在標準狀況下的體積將_______________.
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L.
【答案】(1)2I-+Cl2═I2+2Cl-;(2)I2+SO2+2H2O═2I-+SO42-+4H+;
(3)SO2>I->Cl-;(4)①7.3g; ②D
【解析】
試題分析:(1)在淀粉碘化鉀溶液中通入少量氯氣,立即會看到溶液變藍色,證明有I2生成,離子方程式為:2I-+Cl2═I2+2Cl-;(2)在碘和淀粉形成的藍色溶液中通入SO2氣體,發現藍色逐漸消失,證明I2與SO2發生氧化還原反應,離子方程式為:I2+SO2+2H2O═2I-+SO42-+4H+;(3)在實驗(1)的反應中,碘元素化合價升高,被氧化,I-作還原劑,I2為氧化產物;氯元素化合價降低,被還原,Cl2作氧化劑,Cl-為還原產物;故還原性:I->Cl-;在實驗(2)的反應中,碘元素化合價降低,被還原,I2作氧化劑,I-為還原產物;硫元素化合價升高,被氧化,SO2作還原劑,SO42-為氧化產物;故還原性:SO2>I-;故答案:SO2>I->Cl-;(4)①氯元素由-1價升高為0價,當有5mol Cl2生成時,被氧化HCl為10mol,轉移電子的物質的量為10mol,因此當有0.2mole-轉移時被氧化的HCl為0.2mol,質量為![]() ;②20mL 12molL-1的濃鹽酸的物質的量為:
;②20mL 12molL-1的濃鹽酸的物質的量為:![]() ;假設HCl全部參加反應,則
;假設HCl全部參加反應,則![]() ,故生成氯氣的物質的量為
,故生成氯氣的物質的量為![]() ,收集到氯氣在標準狀況下的體積為:
,收集到氯氣在標準狀況下的體積為:![]() 。但是實際上0.24mol的HCl并未全部參加反應,原因有二,第一,濃鹽酸易揮發;第二,隨著反應進行,濃鹽酸逐漸變為稀鹽酸,而稀鹽酸不與二氧化錳反應。因此,實際上收集到的氯氣在標準狀況下的體積<1.68L,故答案D。
。但是實際上0.24mol的HCl并未全部參加反應,原因有二,第一,濃鹽酸易揮發;第二,隨著反應進行,濃鹽酸逐漸變為稀鹽酸,而稀鹽酸不與二氧化錳反應。因此,實際上收集到的氯氣在標準狀況下的體積<1.68L,故答案D。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】NaHCO2和Na2O2按2:1的個數之比混合,在密閉容器中加熱使之充分反應,然后趁熱排出氣體物質,容器內殘留物的成分是
A.只有 Na2CO3 B.NaHCO3和Na2CO3
C.NaOH和Na2CO3 D.Na2O2和NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關氯及其化合物的說法錯誤的是
A.工業上電解熔融的氯化鈉可以制備鈉
B.工業上用Cl2和石灰乳為原料制造漂白粉
C.工業上電解飽和氯化鎂溶液可制取金屬鎂
D.工業上常用H2在Cl2中燃燒生成的氯化氫溶于水來制取鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、D、E均為化學中的常見物質,它們之間的轉化關系如圖所示(部分產物略去),則下列有關物質的推斷不正確的是( )

A. 若A是鐵,則E可能為稀硝酸
B. 若A是CuO,E是碳,則B為CO
C. 若A是NaOH溶液,E是CO2,則B為NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液與100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4種離子:X+、![]() 、H+、OH-下列分析結果肯定錯誤的是( )。
、H+、OH-下列分析結果肯定錯誤的是( )。
A.CY->CX+>CH+>COH- B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等體積混合,則混合液中粒子濃度關系正確的是( )
A.C(CH3COO-)<C(Na+)
B.C(CH3COOH)>C(CH3COO-)
C.2C(H+)=C(CH3COO-)-C(CH3COOH)
D.C(CH3COOH)+C(CH3COO-)=0.01mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業合成氨:N2(g)+3H2(g)![]() 2NH3(g) △H<0,氨又可以進一步制各硝酸,在工業上一般可進行連續生產。請回答下列問題:
2NH3(g) △H<0,氨又可以進一步制各硝酸,在工業上一般可進行連續生產。請回答下列問題:

若有68g氨氣經催化氧化完全生成NO(g)和H2O(g)所放出的熱量為___________KJ。
(2)合成氨反應達到平衡后,某時刻改變下列選項中的__________條件,在達到新平衡的過程中逆反應速率始終增大。
a.升溫 b.縮小容積 c.增大c(N2) d.使用催化劑
(3)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對合成氨反應的影響。實驗結果如下圖所示:(圖中T表示溫度,橫軸表示起始時H2的物質的量,縱軸表示平衡時NH3的體積分數)
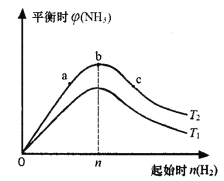
圖像中T1和T2的關系是:T1____________T2 (填“>”“<”或“=”)。
比較在a、b、c三點所處的平衡狀態中,反應物N2的轉化率最大的是_______________(填字母)。
③若容器容積為1L,b點對應的起始時n(H2)=0.30mol,測得平衡時H2的轉化率為60%,則平衡時c(N2)為_________________mo1·L-1。(已知反應物的物質的量按n(H2):n(N2)=3:1投料時,平衡時NH3的體積分數最大)
(4)一定溫度下,將2mol N2和4mol H2置于1L的恒容密閉容器中反應,測得不同溫度(T)、不同時間段內工業合成氨反應中N2的轉化率,得到數據如下表所示:
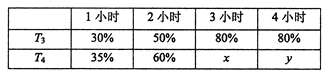
上表中x、y的大小關系為x_____________y。(填“>”“=”“<”“≥”或“≤”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)①現有11g CO2和5.5g N2O的物質的量之比為 ,摩爾質量之比為 ,氧原子的個數之比為 .
(2)質量相等的兩種物質SO2和SO3,兩種物質中硫元素質量之比為 ___________ ,分子物質的量之比為 ___________ ,所含氧原子個數之比為 ___________ .
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-離子濃度之比為 ___________ ,SO42-離子數目之比為 ___________ .
(4)20.6g NaR含有Na+0.2mol,則NaR的摩爾質量為 ___________ ,則含R 8.0g的NaR的物質的量為 ___________ mol.
(5)實驗室用二氧化錳與濃鹽酸反應制取氯氣,反應方程式如下:
MnO2+4HCl(濃)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
若0.1molMnO2與足量的濃鹽酸充分反應,則有 __________ mol HCl被氧化,轉移電子的物質的量為 __________ mol,產生的Cl2在標準狀況下的體積為 __________ L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應A2(g)+B2(g)=2AB(g)的能量變化如圖所示,下列敘述中正確的是( ) 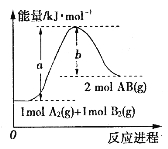
A.該反應的△H=(b-a)KJ·mol-1
B.每生成2個AB分子吸收(a-b)KJ熱量
C.該反應中反應物的總鍵能大于生成物的總鍵能
D.斷裂1mol A-A鍵和1mol B-B鍵,放出a KJ能量 、
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】保護環境、保護地球已成為人類共同的呼聲。下列措施不利于環境保護的是( )
A. 推廣使用無鉛汽油 B. 提倡使用太陽能
C. 推廣使用無磷洗衣粉 D. 提倡個人使用大批量汽車
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com