
 W (s) + 3H2O (g) 請回答下列問題:
W (s) + 3H2O (g) 請回答下列問題: WI4 (g)。下列說法正確的有__________。
WI4 (g)。下列說法正確的有__________。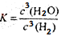 (1分)
(1分) W (s) + 3H2O (g) ⊿m
W (s) + 3H2O (g) ⊿m W (s) + 3H2O (g)
W (s) + 3H2O (g) 

 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源:不詳 題型:填空題
 B(g)+C(g) △H ="+85.1" kJ· mol-1
B(g)+C(g) △H ="+85.1" kJ· mol-1| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 總壓強p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反應時間t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
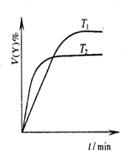
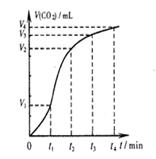
A.圖1表示可逆反應“2X(g) Y(g)△H <0”,溫度T1<T2的情形 Y(g)△H <0”,溫度T1<T2的情形 |
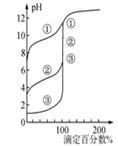
| B.用0.1000 mol·L-1NaOH溶液分別滴定濃度相同的三種一元酸,由圖2曲線可確定①的酸性最強 |
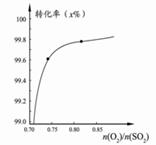
C.在其它條件不變時,2SO2(g) +O2(g)  2SO3(g)轉化關系(如圖3)中,縱坐標表示O2的轉化率 2SO3(g)轉化關系(如圖3)中,縱坐標表示O2的轉化率 |
| D.圖4表示碳酸鈣與鹽酸反應收集到氣體最多的時間段是t3~t4 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題

| A.達平衡時,CH4( g)的轉化率為75% |
| B.0~10 min 內,v(CO)=0.075 mol?L-1·min-1 |
| C.該反應的化學平衡常數K=0.1875 mol?L-1 |
| D.當CH4(g)的消耗速率與H2O(g)的生成速率相等,反應到達平衡 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 CH3OCH3(g) +H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖所示,下列說法正確的是
CH3OCH3(g) +H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖所示,下列說法正確的是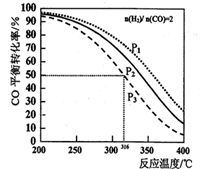
| A.上述反應△H>0 |
| B.圖中P1<P2<P3 |
| C.若在P3和316℃時,測得容器中n(H2)=n(CH3OCH3),此時v(正)<v(逆) |
| D.若在P3和316℃時,起始時n(H2)/n(CO)=3,則達到平衡時,CO轉化率小于50% |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2NH3(g) △H<0。在一體積為2L的密閉容積中,加入0.20mol的N2和0.60mol的H2,反應中NH3的物質的量濃度的變化情況如圖所示,
2NH3(g) △H<0。在一體積為2L的密閉容積中,加入0.20mol的N2和0.60mol的H2,反應中NH3的物質的量濃度的變化情況如圖所示,
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2SO3(g) ΔH<0
2SO3(g) ΔH<0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com