
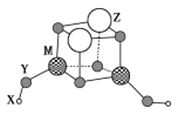
���}Ŀ��������Ԫ�� X��Y��Z��M��ԭ����(sh��)�������������M��һ�N�F(tu��n)�ط���Z2M2Y4(YX)2���Y(ji��)��(g��u)��D��ʾ��X��M������(sh��)������������(sh��)��Yԭ�Ӻ����������Ӕ�(sh��)������ӿ���(sh��)��![]() �������f�����_����
�������f�����_����
A.��(ji��n)���x�Ӱ돽: Z>M>Y
B.������Z��M�Ć��|(zh��)�������ڝ�����
C.X�cY�Y(ji��)���γɵĻ��������x�ӻ�����
D.���I(y��)�ϳ���늽�Z���Ȼ��������Һ����ȡZ���|(zh��)
���𰸡�D
��������
X��M������(sh��)������������(sh��)���Y(ji��)�ψF(tu��n)�ط��ӽY(ji��)�Ͽ�֪X��H��M��Be��Al��Yԭ�Ӻ����������Ӕ�(sh��)������ӿ���(sh��)��![]() ���tY��O��Y��ԭ����(sh��)С��M���tM��Al������(j��)�F(tu��n)�ط��ӵĽY(ji��)��(g��u)��֪�����ʽ��(y��ng)��Al2Z2H2O6��Z�Ļ��σr(ji��)��+2�r(ji��)���tZ��Mg��
���tY��O��Y��ԭ����(sh��)С��M���tM��Al������(j��)�F(tu��n)�ط��ӵĽY(ji��)��(g��u)��֪�����ʽ��(y��ng)��Al2Z2H2O6��Z�Ļ��σr(ji��)��+2�r(ji��)���tZ��Mg��
A���x�Ӻ�����ӌӔ�(sh��)��ͬ�r(sh��)��ԭ����(sh��)ԽС��돽ԽС�����Ժ�(ji��n)���x�Ӱ돽��O2->Mg2+>Al3+����A�e(cu��)�`��
B�������½����X�c�������(hu��)�g������B�e(cu��)�`��
C��X�cY�γɵĻ������H2O2��H2O�����鹲�r(ji��)�������C�e(cu��)�`��
D��Z��Mg�����I(y��)�ϳ�늽����ڠ�B(t��i)�µ��Ȼ��V��ȡ�V���|(zh��)����D���_��
�ʴ𰸞�D��


 �����}�������DŮ��ͯ������ϵ�д�
�����}�������DŮ��ͯ������ϵ�д�
| �꼉(j��) | �����n�� | �꼉(j��) | �����n�� |
| ��һ | ��һ���M(f��i)�n�����]�� | ��һ | ��һ���M(f��i)�n�����]�� |
| �߶� | �߶����M(f��i)�n�����]�� | ���� | �������M(f��i)�n�����]�� |
| ���� | �������M(f��i)�n�����]�� | ���� | �������M(f��i)�n�����]�� |
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�����������ָ�܌�̫���ֱ���D(zhu��n)�Q����ܵIJ��ϡ���������ַQ̫��ܲ��ϣ�ֻ�а댧(d��o)�w���Ͼ����@�N���ܡ�����̫�늳ز��ϵ��Іξ��衢�ྦྷ�衢�Ǿ��衢GaAs��GaAlAs��InP��CdS��CdTe��CuInSe�ȡ�
��1����֪Se�����ڱ���λ�Þ�_____����Ļ��B(t��i)ԭ������Ų�ʽ��_____,���B(t��i)Gaԭ�Ӻ������ռ��(j��)������ܼ�(j��)��_____���~�Ļ��B(t��i)ԭ�Ӄr(ji��)����Ų��D��_____��
��2��P��S��Ga�ؓ(f��)�ԏĴ�С�����?y��n)?/span>_____��
��3���cAlԪ��̎��ͬһ�������Ԫ�ؾ���ȱ����ԣ��仯�����������мӺ��ԣ��������(H3BO3)��ˮ��Һ�����cˮ����(y��ng)����[B(OH)4]-���w�F(xi��n)һԪ��������|(zh��)��[B(OH)4]-�ĽY(ji��)��(g��u)ʽ��____����(bi��o)����λ�I��
��4����֪[Cu(H2O)4]2+���Ќ�(du��)�Q�Ŀ��g��(g��u)�ͣ�[Cu(H2O)4]2+�е�2��(g��)H2O��Cl-ȡ�����ܵõ�2�N��ͬ�Y(ji��)��(g��u)�Įa(ch��n)��t[Cu(H2O)4]2+�Ŀ��g��(g��u)�͞�_____��
��5��AsԪ�صĵ�һ��x��____SeԪ�صĵ�һ��x��(����ڡ�����С�ڡ����ڡ�)��ԭ����__________��
��6��̫�늳ز��ϵĺܶ���ٻ���ٻ��������Ɵ��r(sh��)��(hu��)�a(ch��n)������Ļ����ɫ��Ո(q��ng)��ԭ�ӽY(ji��)��(g��u)��֪�R(sh��)�U���a(ch��n)���ˬF(xi��n)���ԭ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�����h(hu��n)���ƌW(xu��)�����l(f��)���҇����в��T������r(ji��)�F��^�����c��Na2S2O8������S��+6�r(ji��)��ȥ���Uˮ�е�����r(ji��)��[As(V)]���о��ɹ����䷴��(y��ng)�C(j��)��ģ����D��ʾ��Ksp[Fe(OH)3]=2.7��10-39�����Д����e(cu��)�`����
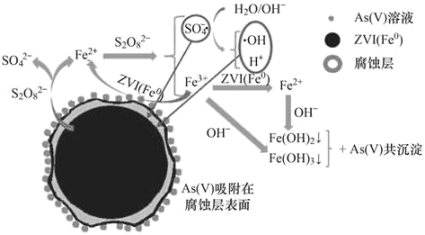
A.pHԽС��Խ������ȥ���Uˮ�е�����r(ji��)��
B.1mol�^�����c��Na2S2O8����NA��(g��)�^���I
C.�A�ԗl���£���������ɻ��l(f��)������(y��ng)�ķ���ʽ�飺SO4-+ OH- = SO42-+OH
D.�Ҝ��£����g�a(ch��n)��Fe(OH)3����ˮ�������Һ��c(Fe3+)�s��2.7��10-18mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�����������ᣨNOSO4H����Ʒ�����νY(ji��)�����������ᣬ��ˮ�ֽ⣬��������Ⱦ�ϡ�SO2�͝������ڝ�������ڕr(sh��)���Ƃ�NOSO4H������(y��ng)ԭ��飺SO2 + HNO3 = SO3 + HNO2��SO3 + HNO2 = NOSO4H��
��1�����������ᣨNOSO4H�����Ƃ䡣
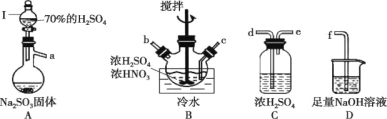
�كx��I�����Q��______________�����_��������l(f��)�F(xi��n)Һ�w���µΣ����ܵ�ԭ����_________________��
�ڰ����������ҵ���������x�����B�����?y��n)?/span>__________________(��x���ӿ���ĸ�����փx�����؏�(f��)ʹ��)��
��A�з���(y��ng)�ķ���ʽ��___________��
��B������ˮ���Ĝض�һ�������20�����ضȲ����^���^�͵�ԭ��?y��n)?/span>________��
��2�����������ᣨNOSO4H�����ȵĜy(c��)����
�Qȡ1.500 g�a(ch��n)Ʒ����250 mL�ĵ���ƿ�У�������100.00 mL��Ȟ�0.1000 mol��L-1��KMnO4��(bi��o)��(zh��n)��Һ��10 mL 25%��H2SO4���u����0.5000 mol��L-1��Na2C2O4��(bi��o)��(zh��n)��Һ�ζ����ζ�ǰ�x��(sh��)1.02 mL, ���_(d��)�ζ��K�c(di��n)�r(sh��)�x��(sh��)��31.02 mL��
��֪��i����KMnO4 + ��NOSO4H + ��______ = ��K2SO4 + ��MnSO4 + ��HNO3 + ��H2SO4
ii��2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 +10CO2��+ 8H2O
����ɷ���(y��ng)i�Ļ��W(xu��)����ʽ��_____________
��KMnO4 + ��NOSO4H + ��______ = ��K2SO4 + ��MnSO4 + ��HNO3 + ��H2SO4
�ڵζ��K�c(di��n)�ĬF(xi��n)���____________________��
�ۮa(ch��n)Ʒ�ļ��Ȟ�__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��ijͬ�W(xu��)����D��ʾ��(sh��)�(y��n)�b��̽���~�c������ķ���(y��ng)��ӛ䛌�(sh��)�(y��n)�F(xi��n)������������f�����_����
ԇ�� | �� | �� | �� | �� |
��(sh��)�(y��n)�F(xi��n)�� | ��Һ�Ԟ�oɫ���а��F����ɫ���w�a(ch��n)�� | �д�����ɫ�����a(ch��n)�� | ��������ɫ�����a(ch��n)�� | Ʒ�t��Һ��ɫ |
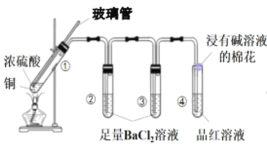
A.���а�ɫ������BaSO3
B.���п����в��֝�����]�l(f��)��
C.���˴_�����а�ɫ���w�Ƿ�������~��������s���ԇ����ע��ˮ����ʎ
D.��(sh��)�(y��n)�r(sh��)�������b�Ã�(n��i)ͨ������N2���ټӟ�ԇ�ܢ٣���(sh��)�(y��n)�F(xi��n)��׃
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�������f�����_����( )
A.һ���l���£����������������ǡ������|(zh��)�����cˮ�l(f��)��ˮ�ⷴ��(y��ng)
B.C3H6�cC4H8һ������ͬϵ��
C.ȫ�������� ![]() ���ɭh(hu��n)������
���ɭh(hu��n)������![]() �� CO2�s���Ƶ�
�� CO2�s���Ƶ�
D.һ���l���£���ȫȼ�� 14 g �����|(zh��)����?j��n)?sh��)�� a ����ϩ����ȩ�Ļ�Ϛ��w������ˮ���|(zh��)����18(1-a)g
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��N2H4��H2O��ˮ���£��O���Ҳ���(w��n)����100�������ֽ�ʧˮ��������߀ԭ���ͳ�������ͨ������N2��H2O���������c(di��n)�飭40�棬���c(di��n)118.5�档�F(xi��n)��Cl2��NaOH��(NH2)2CO�����أ���SO2��ԭ�Ͽ��Ƃ�N2H4��H2O�͟oˮNa2SO3������Ҫ�������£�
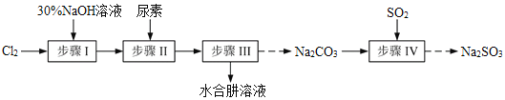
��֪��Cl2(g)��2OH-(aq)=ClO-(aq)��Cl-(aq)��H2O(aq) ��H<0
��1������30%NaOH��Һ�r(sh��)�����貣���x������Ͳ�������⣬߀��Ҫ_____________�����(bi��o)̖(h��o)����
A������ƿ B���z�^�ι� C�������� D���F��ƿ
��2�����E���Ƃ�NaClO��Һ�r(sh��)�����ضȳ��^40�棬Cl2�cNaOH��Һ��ַ���(y��ng)����NaClO3��NaCl����(sh��)�(y��n)�О���Ʒ���(y��ng)�ضȳ����ñ�ˮԡ�����?j��n)����⣬߀���ȡ�Ĵ�ʩ��_______________________��
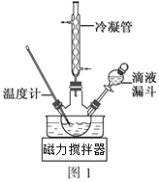
��3�����E��ϳ�N2H4��H2O���b����D1��ʾ��NaClO�A����Һ�c����ˮ��Һ��40�����·���(y��ng)һ�Εr(sh��)�g����Ѹ��������110���^�m(x��)����(y��ng)����(sh��)�(y��n)��ͨ�^��Һ©���μӵ���Һ��_____________������ĸ����
a��������Һ b��NaClO�A����Һ c��������Һ��NaClO��Һ���x��һ
������____________________________________��
��4�����E���з��x��N2H4��H2O��(y��ng)ԓ���õķ����������____________________��
��5�����E���ò��E��õ��ĸ��a(ch��n)ƷNa2CO3�Ƃ�oˮNa2SO3��ˮ��Һ��H2SO3��HSO3-��SO32-�SpH�ķֲ���D2��ʾ��Na2SO3���ܽ��������D3��ʾ����
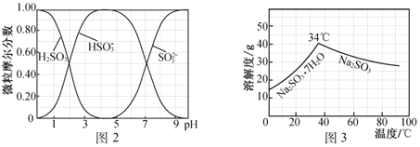
��߅����߅��Na2CO3��Һ��ͨ��SO2�Ƃ�NaHSO3��Һ����(sh��)�(y��n)�д_���Εr(sh��)ֹͣͨSO2�ķ�����______________��
��Ո(q��ng)�a(b��)��������NaHSO3��Һ�Ƃ�oˮNa2SO3�Č�(sh��)�(y��n)������_________________________________���������oˮ�Ҵ�ϴ�죬����ܷ���b��
��6�����I(y��)��߀������ˮ����߀ԭ����ȡ�⻯�c����ˇ������D��
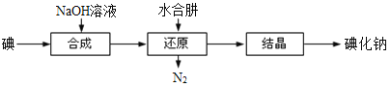
߀ԭ�^���п������c���Fм�����|(zh��)���ˮ���£���ˮ����߀ԭ���ƵõĮa(ch��n)Ʒ���ȸ��ߣ�ԭ����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ��ij�dȤС�M�ڌ�(sh��)�(y��n)�����Ҵ�����������廯�c��ˮ��Ϸ���(y��ng)���Ƃ������飬��̽������������|(zh��)�����P(gu��n)��(sh��)��(j��)Ҋ�±���
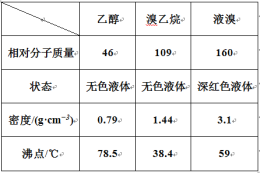
I. ��������Ƃ�
����(y��ng)ԭ�����£���(sh��)�(y��n)�b�����ψD���ӟ��b�á��A���b�þ�ʡ�ԣ���
H2SO4+NaBr ![]() NaHSO4+HBr�� CH3CH2OH+HBr
NaHSO4+HBr�� CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
��1�� �D����A �x�������Q_____���D��B �����ܵ����Þ�_____��
��2�� ��D����A �ӟ�ض��^�������ĝ���^����(hu��)ʹ C ���ռ����Ĵ֮a(ch��n)Ʒ�ʳ�ɫ��ԭ����A �аl(f��)���˸�����(y��ng)������_____��F �B�ӌ�(d��o)��ͨ��ϡNaOH ��Һ�У���Ŀ����Ҫ������_____��β���ֹ��Ⱦ�՚�
II. ���������|(zh��)��̽��
����D��(sh��)�(y��n)�b���(y��n)�C����������|(zh��)��
��3�� ������ԇ�܃�(n��i)���� 10mL6mol��L ��1NaOH ��Һ�� 2mL �����飬��ʎ���o�ã�Һ�w�ӣ�ˮԡ�ӟᡣԓ�^���еĻ��W(xu��)����ʽ��_______��
��4�� ������ԇ����� NaOH ��Һ�Q��NaOH �Ҵ���Һ�����C���a(ch��n)�����ϩ�������ɵĚ��wͨ����D���b�á�a ԇ���е�ˮ��������_______�����o a ԇ�ܣ������ɵĚ��wֱ��ͨ�� b ԇ���У��t b�е�ԇ�����Ԟ� _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л��W(xu��) ��Դ�� �}�ͣ�
���}Ŀ�������P(gu��n)ϵ���_����( )
A. ���c(di��n)�����飾2��2-�������飾2��3-�������飾����
B. �ܶȣ�CCl4��CHCl3��H2O����
C. �����|(zh��)����?j��n)?sh��)�����飾���飾��ϩ����Ȳ����
D. ���|(zh��)�������|(zh��)ȼ����O2�����������飾��ϩ������
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com