
【題目】電滲析法淡化海水裝置示意圖如下,電解槽中陰離子交換膜和陽離子交換膜相間排列,將電解槽分隔成多個獨立的間隔室,海水充滿在各個間隔室中。通電后,一個間隔室的海水被淡化,而其相鄰間隔室的海水被濃縮,從而實現了淡水和濃縮海水分離。下列說法正確的是( )
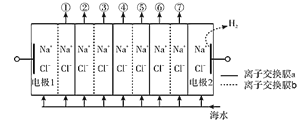
A.離子交換膜a為陰離子交換膜
B.通電時,電極2附近溶液的pH增大
C.淡化過程中,得到的濃縮海水沒有任何使用價值
D.各間隔室的排出液中,②④⑥為淡水
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】乙烯氣相直接水合反應制備乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡轉化率隨溫度、壓強的變化關系如下(起始時,n(H2O)=n(C2H4)=1 mol,容器體積為1 L)。下列分析不正確的是( )
C2H5OH(g)。乙烯的平衡轉化率隨溫度、壓強的變化關系如下(起始時,n(H2O)=n(C2H4)=1 mol,容器體積為1 L)。下列分析不正確的是( )
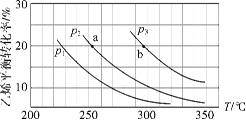
A.乙烯氣相直接水合反應的H<0
B.圖中壓強的大小關系為:p1>p2>p3
C.圖中a點對應的平衡常數K =![]()
D.達到平衡狀態a、b所需要的時間:a>b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是地球上含量豐富的一種元素,其單質及化合物在工農業生產、生活中有著重要作用。
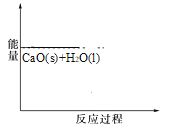
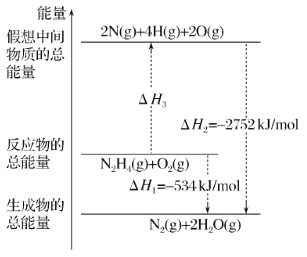
(1)如圖是1mol NO2(g)和 1mol CO(g)反應生成 1mol CO2(g)和 1mol NO(g)過程中能量變化示意圖。

①該反應是_________(填“吸熱”或 “放熱”)反應。
②請寫出反應的熱化學方程式_________。
③若在該反應體系中加入催化劑對反應熱_________(填“有”或“沒有”)影 響。原因是_________。
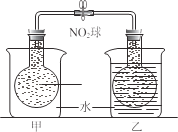
(2)已知,可逆反應2NO2 (g)N2O4 (g) ΔH=56.9 kJ/mol。在乙燒杯中投入一定量的CaO固體,此燒杯中NO2球的紅棕色變深。根據現象,補全CaO與H2O反應過程的能量變化示意圖_________。
(3)肼(N2H4)是一種應用廣泛的化工原料,可作為火箭發動機的燃料。已知斷裂 1 mol 化學鍵所需的能量:N≡N 為 942 kJ、O=O 為 500 kJ、N-N 為154 kJ,則斷裂 1 mol N-H 鍵所需的能量是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應![]() ,在某溫度下的平衡常數為400。此溫度下,在密閉容器中加入
,在某溫度下的平衡常數為400。此溫度下,在密閉容器中加入![]() ,反應進行到某時刻測得各組分的濃度如下:
,反應進行到某時刻測得各組分的濃度如下:
物質 |
|
|
|
濃度 |
|
|
|
下列敘述中正確的是![]()
A.該反應的平衡常數表達式為 ![]()
B.該時刻正、逆反應速率的大小:![]()
C.平衡時![]()
D.若加入![]() 后,經
后,經![]() 反應達到平衡,該時間內反應速率
反應達到平衡,該時間內反應速率![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某銅鈷礦石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中還含有一定量的Fe2O3、MgO和CaO等。由該礦石制備Co2O3的部分工藝過程如下:
I.將粉碎的礦石用過量的稀H2SO4和Na2SO3溶液浸泡,過濾,分離除去沉淀a。
II.浸出液除去含銅的化合物后,向溶液中先加入NaClO3溶液,再加入一定濃度的Na2CO3溶液,過濾,分離除去沉淀b[主要成分是Na2Fe6(SO4)4(OH)12]。
III.向上述濾液中加入足量NaF溶液,過濾,分離除去沉淀c。
IV.III中濾液加入濃Na2CO3溶液,獲得CoCO3沉淀。
V.將CoCO3溶解在鹽酸中,再加入(NH4)2C2O4溶液,產生 CoC2O4·2H2O沉淀。分離出沉淀,將其在400℃~600℃ 煅燒,即得到Co2O3。
請回答:
(1)I 中,沉淀a的成分是_____,稀硫酸溶解CoCO3的化學方程式是_____, 加入Na2SO3溶液的主要作用是_________。
(2)根據圖1、圖2

①礦石粉末浸泡的適宜條件應是:溫度_____、pH_____。
②圖2中銅、鈷浸出率下降的可能原因是_____。
(3)II中,浸出液中的金屬離子與NaClO3反應的離子方程式:ClO![]() +_____+_____== Cl- +_____+ _____
+_____+_____== Cl- +_____+ _____
(4)I中,檢驗鐵元素完全除去的試劑是_____,實驗現象是_____。
(5)I中,沉淀c的成分是CaF2、_____(填化學式)。
(6)V中,加入Na2CO3的作用是_____。
(7)V中,分離出純凈的CoC2O4·2H2O的操作是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有a、b、c、d四個金屬電極,有關的反應裝置及部分反應現象如下:
實驗裝置 | 部分實驗現象 |
| a極質量減小,b極質量增加 |
| b極有氣體產生,c極無變化 |
| d極溶解,c極有氣體產生 |
| 電流計指示在導線中電流從a極流向d極 |
由此可判斷這四種金屬的活動性順序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據央廣新聞報道,2016年我國河南桐柏縣發現特大金礦,含金量近105噸可挖80年。除了發現的特大金礦,同時還發現大量天然堿、鉛鋅礦產資源。根據上述信息,回答下列問題:
(1)鉛原子的價層電子排布式為__________,原子核外有__________個未成對電子。
(2)鋅與鎵(Ga)同周期,鋅的第一電離能大于鎵的第一電離能,其原因是________________。
(3)天然堿的化學式為Na2CO3·NaHCO3·2H2O。
(I)天然堿的晶體類型是__________;H2O的VSEPR模型為______________。
(Ⅱ)Na2CO3中存在的作用力類型主要有__________,CO32-中C的雜化類型為___________。
(4)金是貴重金屬。冶金工業上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。與CN一互為等電子體的離子有________(任寫一種),HCN分子中σ鍵和π鍵數目之比為_________。
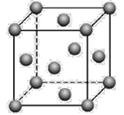
(5)金晶體的晶胞結構如圖所示。已知金的密度為ρ g·cm3,摩爾質量M(Au)=197g·mol-1,阿伏加德羅常數為NA。則晶體中金原子的配位數為_______,金原子(或粒子)的半徑r=___pm(用含ρ和NA的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
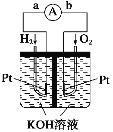
【題目】氫氧燃料電池是符合綠色化學理念的新型發電裝置。如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定。其正極反應方程式為____________,若將負極材料改為CH4,寫出其負極反應方程式______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美托洛爾可用于治療高血壓及心絞痛,某合成路線如下:

回答下列問題:
(1)寫出C中能在NaOH溶液里發生反應的官能團的名稱______。
(2)A→B和C→D的反應類型分別是___________、____________,H的分子式為______。
(3)反應E→F的化學方程式為______。
(4)試劑X的分子式為C3H5OCl,則X的結構簡式為______。
(5)B的同分異構體中,寫出符合以下條件:①含有苯環;②能發生銀鏡反應;③苯環上只有一個取代基且能發生水解反應的有機物的結構簡式____________。
(6)4-芐基苯酚(![]() )是一種藥物中間體,請設計以苯甲酸和苯酚為原料制備4-芐基苯酚的合成路線:____________(無機試劑任用)。
)是一種藥物中間體,請設計以苯甲酸和苯酚為原料制備4-芐基苯酚的合成路線:____________(無機試劑任用)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com