
(4分) 實驗室可以用高錳酸鉀和濃鹽酸反應制取氯氣,反應的化學方程式如下
2KMnO4+16HCl(濃) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在該反應中,還原劑是 。
(2)若在反應中生成了標況下2.24L氯氣,則電子轉移的個數是 NA。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
Ⅰ.在一體積為10 L的容器中,通入一定量的CO和H2O,在850℃時發生如下反應:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,CO和H2O濃度變化如圖所示:
CO2(g)+H2(g) ΔH<0,CO和H2O濃度變化如圖所示:
(1)0~4 min的平均反應速率v(CO)=________mol/(L·min),反應在第5 min時的平衡常數K=________。
t℃時物質濃度(mol/L)的變化
| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0. 200 | 0. 300 | 0 | 0 |
| 2 | 0. 138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0. 116 | 0. 216 | 0. 084 | |
| 6 | 0. 096 | 0. 266 | 0. 104 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫。請運用化學反應原理的相關知識研究碳及其化合物的性質。
(1)用電弧法合成的儲氫納米碳管常伴有大量的碳納米顆粒(雜質),這種顆粒可用如下氧化法提純,請完成該反應的化學方程式: 
(2)焦炭可用于制取水煤氣。測得12 g 碳與水蒸氣完全反應生成水煤氣時,吸收了131.6 kJ熱量。該反應的熱化學方程式為 。
(3)活性炭可處理大氣污染物NO。在2 L密閉容器中加入NO和活性炭(無雜質),生成氣體E和F。當溫度分別在T1和T2時,測得各物質平衡時物質的量如下表: 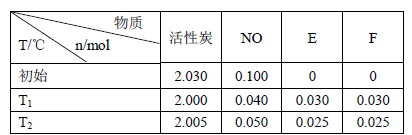
上述反應T1℃時的平衡常數為K1,T2℃時的平衡常數為K2。
Ⅰ.計算K1= 。
Ⅱ.根據上述信息判斷,溫度T1和T2的關系是(填序號) 。
(4)CO2經常用氫氧化鈉來吸收,現有0.4 molCO2,若用200ml 3mol/LNaOH溶液將其完全吸收,溶液中離子濃度由大到小的順序為: 。
(5)CO還可以用做燃料電池的燃料,某熔融鹽燃料電池具有高的發電效率,因而受到重視,該電池用Li2CO3和 Na2CO3的熔融鹽混合物作電解質,CO為負極燃氣,空氣與CO2的混和氣為正極助燃氣,制得在 650 ℃下工作的燃料電池,其負極反應式: 則
則
正極反應式:___ ,電池總反應式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硝酸是一種強氧化性、腐蝕性的強酸,其還原產物因硝酸濃度的不同而有變化,從總體上說,硝酸濃度越高,平均每分子硝酸得到的電子數越少,濃硝酸的還原產物主要為NO2,稀硝酸的還原產物主要為NO。 實驗室中,常用Cu與濃HNO3反應制取NO2,用Cu與稀HNO3反應制取NO。
(1)請寫出實驗室中用Cu與濃HNO3反應制取NO2的化學方程式:_____________。
(2)該反應中發生氧化反應的物質是__________,1 mol氧化劑_________(填“得到”或“失去”)_______ mol電子。
(3)48.0 g Cu與適量的濃HNO3反應,銅全部作用后,共收集到22.4 L氣體(標準狀況下),反應中消耗HNO3的物質的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)實際上硝酸不僅可被還原為NO2或NO,濃度更稀時硝酸還可以被還原為N2O、N2、NH4NO3等。請將3種物質: FeSO4、Fe(NO3)3和Fe2(SO4)3分別填入下面對應的橫線上,組成一個未配平的化學方程式。
HNO3 + ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并寫出配平后的離子方程式:_________________________。
(5)硝酸的還原產物NO、NO2、N2O等對環境均有副作用,為了可持續發展,當今社會提出的一個新概念——“綠色化學”,它要求從經濟、環保和技術上設計可行的化學反應,則下列由單質銅制取硝酸銅的方法可行且符合“綠色化學”的是( )
A.Cu  Cu(NO3)2
Cu(NO3)2
B.Cu 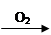 CuO
CuO Cu(NO3)2
Cu(NO3)2
C.Cu 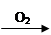 CuO
CuO Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2
D.Cu CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
海洋是資源的寶庫,蘊藏著豐富的化學元素,如氯、溴、碘、鎂等。按要求回答下列問題:
(1)可以證明溴比碘的氧化性強的離子反應方程式為____________________________。
(2)從海帶灰中提取的碘單質,往往含有一定的雜質,通常利用加熱的方法除去雜質,這個過程中主要利用碘性質中的___________,也可以通過萃取分液的方法提取碘,實驗室中分液時,分液漏斗中的上層液體應從分液漏斗的_______(填“上”或“下”)口倒出。
(3)點燃的鎂條可以在二氧化碳氣體中繼續燃燒,該反應的化學方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
部分弱酸的電離平衡常數如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 電離平衡常數 (25℃) | 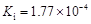 |  | 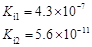 | 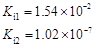 |
 ,但它的氧化性比硫酸還要強。在酸性介質中,碲酸可將HI氧化成I2,方程式如下:
,但它的氧化性比硫酸還要強。在酸性介質中,碲酸可將HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O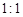 ,試配平上述化學方程式。
,試配平上述化學方程式。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
實驗室里通常用MnO2與濃鹽酸反應制取氯氣,其反應的化學方程式為:
MnO2+4HCl(濃)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在該反應中,如有1 mol Cl2生成,被氧化的HCl的物質的量是 mol,轉移電子的物質的量是 mol。
(2)某溫度下,將Cl2通入NaOH溶液中,反應得到含有ClO-與ClO3-物質的量之比為1∶1的混合液,反應的化學方程式是 。
(3)報紙報道了多起衛生間清洗時,因混合使用“潔廁靈”(主要成分是鹽酸)與“84消毒液”(主要成分是NaClO)發生氯氣中毒的事件。試根據你的化學知識分析,原因是(用離子方程式表示) 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
銅是生物必需的微量元素,也是人類最早使用的金屬之一。銅的生產和使用對國計民生各個方面都產生了深遠的影響。
(1)寫出銅與稀硝酸反應的化學方程式____________________________________________________。
(2)為了保護環境和節約資源,通常先用H2O2和稀硫酸的混合溶液溶出廢舊印刷電路板中的銅,最終實現銅的回收利用。寫出溶出銅的離子方程式__________________________________________________。
(3)工業上以黃銅礦為原料,采用火法溶煉工藝生產銅。該工藝的中間過程會發生反應:2Cu2O+ Cu2S 6Cu+SO2,該反應的氧化劑是___________________;當生成19.2gCu時,反應中轉移的電子為____________mol。
6Cu+SO2,該反應的氧化劑是___________________;當生成19.2gCu時,反應中轉移的電子為____________mol。
(4)銅在潮濕的空氣中能發生吸氧腐蝕而生銹,銅誘的主要成分為Cu2(OH)2CO3(堿式碳酸銅)。試寫出上述過程中負極的電極反應式__________________________。
(5)研究性學習小組用“間接碘量法”測定某試樣中CuSO4·5H2O(不含能與I-反應的氧化性雜質)的含量。取ag試樣配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成。寫出該反應的離子方程式________________________________________。繼續滴加KI溶液至沉淀不再產生,溶液中的I2用硫代硫酸鈉標準溶液滴定,發生反應的化學方程式為:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。則試樣中CuSO4·5H2O的質量分數為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
閱讀下列材料后回答問題。
一個體重60 kg健康的成年人,體內約含有4 g鐵,這4 g鐵在人體內不是以單質的形式存在,而是以Fe2+和Fe3+的形式存在。正二價鐵離子易被吸收,給貧血者補充鐵時,應給予含Fe2+的亞鐵鹽,如硫酸亞鐵。服用維生素C,可使食物中的Fe3+轉化為Fe2+,有利于人體吸收。
(1)在人體中進行Fe2+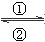 Fe3+的轉化時, ①中的Fe2+作________劑,②中的Fe3+作___________劑。
Fe3+的轉化時, ①中的Fe2+作________劑,②中的Fe3+作___________劑。
(2)“服用維生素C,可使食物中的Fe3+轉化為Fe2+”這句話指出,維生素C在這一反應中作___________劑,具有___________性。
(3)市場出售的某種麥片中含有微量的顆粒細小的還原鐵粉,這些鐵粉在人體胃酸(主要成分是鹽酸)的作用下轉化成亞鐵鹽。此反應的離子方程式為_______________
(并用單線橋法標出該式中的電子轉移方向和數目)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com