
分析 (1)寫出Ti2+核外電子排布式,判斷其最高能層和該能層下的原子軌道數;
(2)a.根據價層電子對互斥理論確定雜化方式;
b.等電子體為原子數相等和價電子數相等的原子團;
c.分子間存在氫鍵的熔沸點高;
d.提供孤電子對的原子是配原子;
(3)先判斷價層電子對數目判斷雜化類型,中心原子的孤電子對對成鍵電子對有排斥作用進而判斷分子中Sn-Br的鍵角;
(4)根據氯化鈉型晶胞判斷;已知晶胞的邊長為 a nm,根據晶胞的密度ρ=$\frac{m}{V}$計算.
解答 解:(1)基態Ti2+價電子排布式為:3d2,最高能層為M層,該能層下含有1個3s軌道、3個3p軌道和5個3d軌道,共有9個原子軌道,
故答案為:M;9;
(2)a.NH3分子中N原子含有3個共用電子對和一個孤電子對,所以其價層電子對是4,采用sp3雜化,故a錯誤;
b.等電子體為原子數相等和價電子數相等的原子團,NH+4與PH+4、CH4、BH-4均含有5個原子團,且價電子均為8,為等電子體,而ClO-4價電子數為32,不屬于等電子體,故b錯誤;
c.分子間存在氫鍵的熔沸點高,相同壓強時,氨氣中含有氫鍵,PH3中不含氫鍵,所以NH3沸點比PH3高,故c正確;
d.提供孤電子對的原子是配原子,[Cu(NH3)4]2+離子中,N原子提供孤對電子,N原子為配原子,故d正確;
故答案為:cd;
(3)SnBr2分子中Sn原子價層電子對個數=2+$\frac{1}{2}$×(4-2×1)=3,所以Sn原子的軌道雜化方式為SP2雜化,且含有一個孤電子對,所以該分子為V形分子,孤電子對對成鍵電子對有排斥作用,所以其鍵角小于120°,
故答案為:sp2雜化;<;
(4)與NaCl晶胞類型一致,其配位數也為6;該晶胞的邊長為a nm,則晶胞體積=a3 ×10-21cm3,根據均攤法可知,在NiO晶胞中含鎳原子數為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧原子數為1+12×$\frac{1}{4}$=4,NiO的摩爾質量為b g•mol-1,所以晶胞的質量為$\frac{4×b}{{N}_{A}}$,所以晶胞的密度ρ=$\frac{m}{V}$=$\frac{4b}{a×1{0}^{-21}×{N}_{A}}$=$\frac{4b×1{0}^{21}}{{a}^{3}×{N}_{A}}$g•cm-3,
故答案為:6;$\frac{4b×1{0}^{21}}{{a}^{3}×{N}_{A}}$.
點評 本題考查物質結構與性質,涉及核外電子排布、雜化方式的判斷、晶胞的計算等知識點,注意[Cu(NH3)4]2+離子的中心原子是提供空軌道的原子,題目難度中等.晶體密度的計算解題時注意均攤法運用和基本計算公式的運用.


科目:高中化學 來源: 題型:選擇題
| A. | 相同條件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 | |
| B. | 2 mol SO2(g)和1 mol O2(g)在密閉容器中充分反應,放出熱量小于Q kJ | |
| C. | 增大壓強或升高溫度,該反應過程都能放出更多的熱量 | |
| D. | 2 mol SO2(g)和1 mol O2(g)在密閉容器中充分反應,放出熱量等于Q kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
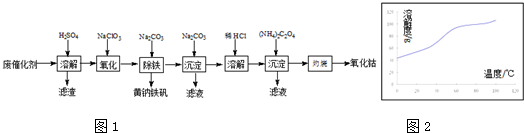
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
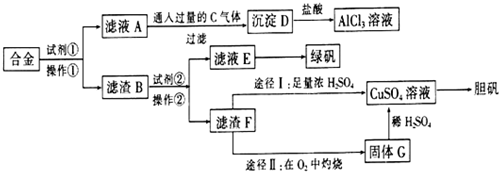
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 配制鹽酸溶液,用量筒取鹽酸時俯視刻度線 | |
| B. | 配制鹽酸溶液定容時,仰視容量瓶 | |
| C. | 稱量4gNaOH配制0.20mol/L NaOH溶液500mL時,砝碼錯放左盤 | |
| D. | 配制NaOH溶液時,溶液未經冷卻即注入容量瓶并定容至刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
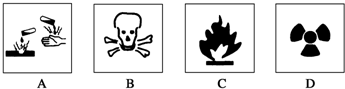
| A. | 濃硫酸----A圖標 | B. | 酒精----B圖標 | ||
| C. | 汽油----C圖標 | D. | 放射性物品----D圖標 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molNH4+的質量為18g | |
| B. | SO2的摩爾質量為64g•mol-1 | |
| C. | 鋁原子的摩爾質量等于它的相對原子質量 | |
| D. | 一個水分子的質量約等于$\frac{18}{6.02×1{0}^{23}}$g |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com