
分析 (1)n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,過氧化鈉和水反應生成氫氧化鈉和氧氣,根據過氧化鈉和氧氣之間的關系式計算氧氣體積;
(2)根據鈉原子守恒計算NaOH的物質的量,再根據c=$\frac{n}{V}$計算溶液濃度.
解答 解:(1)過氧化鈉的物質的量為:n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,
過氧化鈉和水反應生成氫氧化鈉和氧氣,反應的離子方程式為:2Na2O2+2H2O=4Na++4OH-+O2↑,據此可得關系式2Na2O2----O2,
所以生成的氧氣在標準狀況下的體積為:$\frac{0.05mol}{2}$×22.4L/mol=0.56L,
答:生成標準狀況下氧氣的體積為0.56L;
(2)根據鈉原子守恒得n(NaOH)=2n(Na2O2)=2×0.05mol=0.1mol,c(NaOH)=$\frac{0.1mol}{0.1L}$=1mol/L,
答:所得溶液中溶質的物質的量濃度為1mol/L.
點評 本題考查了物質的量的有關計算,題目難度中等,明確發生反應的實質為解答關鍵,注意掌握守恒思想在化學計算中的應用,試題有利于提高學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 對于反應CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化劑,反應過程中放出的熱量更多 | |
| B. | CO燃燒的熱化學方程式為2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反應2Mg+CO2=2MgO+C△H<0從熵變角度看,不可自發進行 | |
| D. | 在密閉容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA個HI分子,反應平衡時,吸熱7.45kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
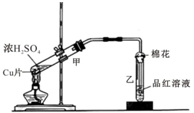 如圖為濃硫酸與銅片反應的裝置.請回答:
如圖為濃硫酸與銅片反應的裝置.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ba2+、SO42-、Cl- | B. | Mg2+、K+、Cl-、NO3- | ||
| C. | H+、K+、CO32-、NO3- | D. | Ag+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 某溫度時,在2L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示.
某溫度時,在2L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該裝置中CCl4的作用是除去產物HBr中混有的Br2蒸氣 | |
| B. | 若將液溴改為濃溴水,該反應也能進行 | |
| C. | 通過AgNO3溶液中有淡黃色沉淀產生,說明由苯制溴苯的反應是取代反應 | |
| D. | 該裝置中左側長導管的作用是導氣兼冷凝回流 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com