
 白云石的主要成份是CaCO3•MgCO3,在我國有大量的分布.以白云石為原料生產的鈣鎂系列產品有廣泛的用途.白云石經煅燒、消化后得到鈣鎂的氫氧化物,再經過碳化實現Ca2+、Mg2+的分離.碳化反應是放熱反應,化學方程式如下:
白云石的主要成份是CaCO3•MgCO3,在我國有大量的分布.以白云石為原料生產的鈣鎂系列產品有廣泛的用途.白云石經煅燒、消化后得到鈣鎂的氫氧化物,再經過碳化實現Ca2+、Mg2+的分離.碳化反應是放熱反應,化學方程式如下:分析 (1)金屬性越強,對應的最高價的氧化物的水化物的堿性越強,氫氧化鈣微溶于水,而氫氧化鎂難溶;
(2)溫度過高,二氧化碳的溶解度減小,且碳酸氫鎂不穩定,如溫度過低,反應速率較小;
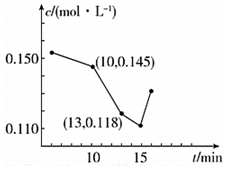
(3)在10min到13min之內鈣離子濃度由0.145mol/L變化為0.118mol/L,結合v=$\frac{△c}{△t}$計算速率;15min之后鈣離子濃度增大,原因是二氧化碳與碳酸鈣反應生成碳酸氫鈣;
(4)Mg原子核外有12個電子,Ca原子核外電子層數比Mg多,原子半徑大,最外層電子距離原子核較遠.
解答 解:(1)金屬性Ca>Mg,金屬性越強,對應的最高價的氧化物的水化物的堿性越強,則Ca(OH)2的堿性比Mg(OH)2的堿性強,
氫氧化鈣微溶于水,而氫氧化鎂難溶,則Ca(OH)2的溶解度比Mg(OH)2的溶解度大,
故答案為:強;大;
(2)溫度過高,二氧化碳的溶解度減小,且碳酸氫鎂不穩定,不利于碳化反應,如溫度過低,反應速率較小,也不利于不利于碳化反應,
故答案為:二氧化碳的溶解度小;碳酸氫鎂分解;反應速率較小;
(3)在10min到13min之內鈣離子濃度由0.145mol/L變化為0.118mol/L,v=$\frac{△c}{△t}$=$\frac{0.145mol/L-0.118mol/L}{3min}$=0.009mol/(L•min),
15min之后鈣離子濃度增大,原因是二氧化碳與碳酸鈣反應生成碳酸氫鈣,反應的方程式為CaCO3+CO2+H2O=Ca(HCO3)2,
故答案為:0.009mol/(L•min);CaCO3+CO2+H2O=Ca(HCO3)2;
(4)Mg原子核外有12個電子,子核外電子排布式為1s22s22p63s2,Ca原子核外電子層數比Mg多,原子半徑大,最外層電子距離原子核較遠,則能量較高,
故答案為:1s22s22p63s2;高于.
點評 本題為2015年上海高考題第四題,綜合考查難溶電解質的溶解平衡、化學反應速率以及核外電子排布等知識,側重于化學與生活、生產的考查,有利于培養學生的良好的科學素養,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 高溫、高壓、催化劑條件下,1 mol N2與足量H2充分反應轉移的電子數為6 NA | |
| B. | 將NO2和NO混合,標準狀況下,22.4 L混合氣體中所含的氮原子總數為2 NA | |
| C. | 常溫下,10 L pH=12的Na2CO3溶液中含有的OH-離子數為0.1NA | |
| D. | 將含有1molFeCl3的濃溶液完全水解可得到Fe(OH)3膠粒的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Ca2+、NO3- | ||
| C. | Na+、AlO2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在t℃時,AgCl在水中的沉淀溶解平衡曲線如圖所示(假設AgCl飽和溶液的密度與水的密度近似相等).下列說法錯誤的是( )
在t℃時,AgCl在水中的沉淀溶解平衡曲線如圖所示(假設AgCl飽和溶液的密度與水的密度近似相等).下列說法錯誤的是( )| A. | 在t℃時,AgCl的Ksp為4×10-10 | |
| B. | 在t℃時,c點溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃時,AgCl的溶解度約為2.9×10-4g | |
| D. | d點溶液,溫度升高后c(Ag+),c(Cl-)均會減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
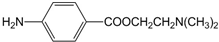 )的三條合成路線如下圖所示(部分反應試劑和條件已省略):
)的三條合成路線如下圖所示(部分反應試劑和條件已省略):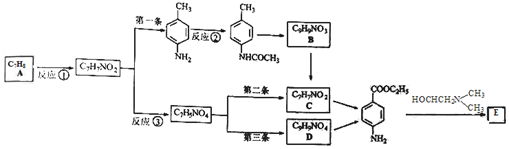
 ;C的名稱是對氨基苯甲酸.
;C的名稱是對氨基苯甲酸.
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北石家莊辛集中學高二上階段考一化學卷(解析版) 題型:選擇題
下列說法中正確的一組是( )
A.H2和D2互為同位素
B.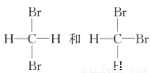 互為同分異構體
互為同分異構體
C.正丁烷和異丁烷是同系物
D.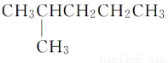 和
和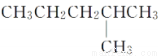 是同一種物質
是同一種物質
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北石家莊辛集中學高二上階段考一化學卷(解析版) 題型:選擇題
下列水解的離子方程式正確的是( )
A.S2-+2H2O H2S+2OH-
H2S+2OH-
B.AlO2一+2H2O Al(OH)3+OH-
Al(OH)3+OH-
C.CO32-+H2O=HCO3-+OH-
D.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省長春市高三上學期期中考試化學試卷(解析版) 題型:選擇題
已知:Kw=1.0×10-14,Al(OH)3 AlO2-+H++H2O,K=2.0×10-13。則Al(OH)3溶于NaOH溶液反應的平衡常數數值為
AlO2-+H++H2O,K=2.0×10-13。則Al(OH)3溶于NaOH溶液反應的平衡常數數值為
A.10
B.15
C.20
D.25
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com