
【題目】鈉、鎂、鋁、鐵是四種重要的金屬。請回答:
(1)鈉的熔點比鐵的熔點__________(填“高”或“低”)。
(2)將一小塊金屬鈉投入水中,發生反應的離子方程式為__________________。
(3)若D為上述四種金屬單質中的一種;A、B為氣體單質,其中A為黃綠色氣體,B為無色氣體;C為化合物,其水溶液顯酸性;F的水溶液遇到KSCN溶液會呈現血紅色。它們之間有下列轉化關系:
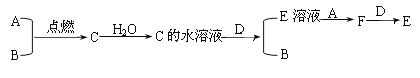
①將紫色石蕊試液滴入A的飽和溶液中,實驗現象為___________________。
②寫出C的水溶液與D反應的離子方程式:________________________。
③在F的水溶液加入D,反應的離子方程式是:______________________。
【答案】低 2Na+2H2O=2Na++2OH-+H2↑ 溶液先變紅后褪色 Fe+2H+=Fe2++ H2↑ Fe+2Fe3+=3Fe2+
【解析】
(3)A、B為氣體單質,其中A為黃綠色氣體,B為無色氣體;C為化合物,其水溶液顯酸性,則A為Cl2,B為H2,C為HCl;D為金屬單質,與鹽酸反應產生H2和E溶液,E與Cl2反應生成F,F的水溶液遇到KSCN溶液會呈現血紅色,說明F中含有Fe3+,F為FeCl3,E為FeCl2,D與F反應,則D為變價金屬Fe,然后利用物質的性質結合題目要求來解答。
(1)Na是堿金屬,熔點很低,只有97.81℃,稍微受熱就熔化變為液態,而Fe的熔點是1535℃,可見,鈉的熔點比鐵的熔點低;
(2)鈉與水反應產生氫氧化鈉和氫氣,反應的離子方程式為:2Na+2H2O=2Na++2OH-+H2↑;
(3)根據上述分析可知:A為Cl2,B為H2,C為HCl;D為Fe,E為FeCl2,F為FeCl3。
①由于氯氣溶于水,和水反應生成鹽酸和次氯酸,鹽酸具有酸性,可以使紫色石蕊試液變紅色,而次氯酸具有強氧化性,會使變紅的石蕊試液又褪色,因此將紫色石蕊試液滴入A的飽和溶液中,看到的現象是溶液先變紅后褪色;
②C的水溶液是鹽酸,具有酸性,與金屬Fe發生置換反應,產生FeCl2和H2,反應的離子方程式為:Fe+2H+=Fe2++ H2↑;
③FeCl3具有強的氧化性,與Fe反應產生FeCl2,所以在含有FeCl3的水溶液加入Fe,反應的離子方程式為:Fe+2Fe3+=3Fe2+。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下圖是利用二氧化硅制備硅及其化合物的流程,下列說法正確的是
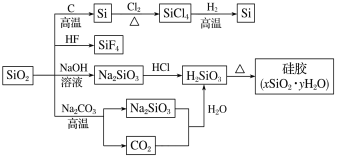
A.SiO2屬于兩性氧化物B.酸性:H2SiO3>H2CO3
C.硅膠吸水后可重復再生D.圖中所示轉化反應都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把6.5gZn放入足量的鹽酸中,鋅完全反應。計算:
(1)6.5gZn的物質的量?_________。
(2)參加反應的HCl的物質的量?_________。
(3)生成氫氣的體積(標準狀況)?__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】掌握儀器的名稱、組裝及使用方法是中學化學實驗的基礎,下圖為兩套實驗裝置:

(1)寫出下列儀器的名稱:①________,②________,④________。
(2)若利用裝置Ⅰ分離四氯化碳和酒精的混合物,還缺少的儀器______,將儀器補充完整后進行的實驗操作的名稱為________;冷凝管的進水口是________(填“f”或“g”)
(3)實驗室用NaOH固體配制250mL 1.25mol/L的NaOH溶液,填空并請回答下列問題:
①配制時,其正確的操作順序是(字母表示,每個字母只能用一次)_________________;
A.用30mL水洗滌燒杯2~3次,洗滌液均注入容量瓶,振蕩
B.用天平準確稱取所需的NaOH的質量,加入少量水(約30mL),用玻璃棒慢慢攪動,使其充分溶解
C.將已冷卻的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.將容量瓶蓋緊,顛倒搖勻
E.改用膠頭滴管加水,使溶液凹面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度1~2cm處
②下列配制的溶液濃度偏低的是_________________;
A.稱量NaOH時,砝碼錯放在左盤
B.向容量瓶中轉移溶液時(實驗步驟C)不慎有液滴灑在容量瓶外面
C.加蒸餾水時不慎超過了刻度線
D.定容時俯視刻度線
E.配制前,容量瓶中有少量蒸餾水
③裝置Ⅱ是某同學轉移溶液的示意圖,指出圖中的錯誤是:___________、____________。
(4)粗鹽中含Ca2+、Mg2+、SO42-等雜質,需要提純后才能綜合利用。粗鹽提純的步驟有:①加入過量的Na2CO3溶液;②加入過量的BaCl2溶液;③加入過量的NaOH溶液;④加入足量的鹽酸;⑤溶解;⑥過濾;⑦蒸發。正確的操作順序是__________(填寫序號字母)。
a.⑤①②③⑥④⑦ b.⑤②①③④⑥⑦ c.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤工業鍋爐煙氣中含有1%-3%的CO和0.02%~0.04%的NO,在新型催化劑作用下可消除CO和NO兩種有害氣體,反應機理如圖所示,在反應過程中CO可被O2氧化。下列說法中正確的是
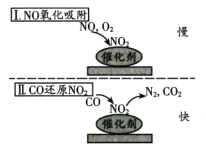
A.溫度越高越有利于有害氣體消除
B.O2濃度越大催化除雜效果越好
C.催化反應的速率由氧化吸附過程決定
D.總反應方程式為2NO+2CO=N2+2CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組都為兩種化合物溶于水時電離出的離子:①Na+、OH-、![]() ,②H+、Cl-、
,②H+、Cl-、![]() ,③Na+、K+、OH-,④Na+、K+、
,③Na+、K+、OH-,④Na+、K+、![]() ,其中按照僅由酸、堿、鹽依次電離的是( )
,其中按照僅由酸、堿、鹽依次電離的是( )
A. ②③④ B. ②①④
C. ②③① D. ②①③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】DL—m—絡氨酸是一種營養增補劑,能提高人體的免疫力。一種合成DL—m一絡氨酸的路線如下:
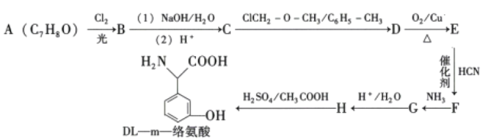
已知:①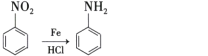
②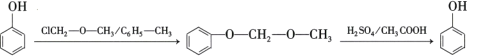
③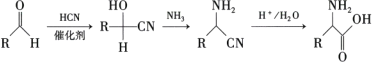
回答下列問題:
(1)A的化學名稱為 ________,F中含氧官能團的名稱是________。
(2)E到F的反應類型為________。
(3)寫出D到E的化學方程式________。
(4)化合物M是一種α-氨基酸,是H的同分異構體。滿足以下條件的M的同分異構體有________種。
i.環上有兩個處于鄰位上的取代基,與FeCl3溶液不能發生顯色反應;
ii.1molM與足量金屬鈉反應產生1.5molH2。
其中分子中存在兩個手性碳原子,且能在濃硫酸催化加熱條件下發生消去反應而消除旋光性,該異構體的結構簡式為________、________(已知:分子中存在手性碳原子的分子叫手性分子,手性分子具有旋光性)。
(5)![]() 是合成藥物撲熱息疼的中間體。設計由苯酚和ClCH2—O—CH3制備
是合成藥物撲熱息疼的中間體。設計由苯酚和ClCH2—O—CH3制備![]() 的合成路線________(無機試劑任選。)
的合成路線________(無機試劑任選。)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知1 g氫氣完全燃燒生成水蒸氣時放出熱量121 kJ。且氧氣中1 mol O=O鍵完全斷裂時吸收熱量496 kJ,水蒸氣中1 mol H-O鍵形成時放出熱量463 kJ,則氫氣中1mol H-H鍵斷裂時吸收熱量為( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某探究學習小組用一定量的乙醇和鈉反應推測乙醇結構,實驗裝置圖如圖所示.關于實驗操作或敘述錯誤的是

A.實驗時應保證乙醇足量,讓鈉反應完全
B.裝置b中進氣導管不應插入水中,排水導管應插到集氣瓶底部
C.通過測定放出氫氣氣體的體積計算乙醇中活潑氫的數目,從而推測乙醇的結構
D.從量筒中讀取排除出水的體積時,應注意上下移動量筒使量筒內的液面與集氣瓶中的液面相平
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com