
【題目】【題目】下列描述中正確的是 ( )
A. 純堿溶于熱水后去污效果增強,說明純堿的水解反應是吸熱反應
B. NH3(g) + HCl(g) = NH4Cl(s) 在較低溫度下能自發進行,說明該反應的ΔH>0
C. 500℃、30 MPa下,將7 g N2和3 g H2置于密閉容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃燒熱(ΔH)為-890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
【答案】A
【解析】A. 純堿溶于熱水后去污效果增強,說明升高溫度促進了水解,使水解平衡正向移動,所以可以說明純堿的水解是吸熱反應,故A正確;B. 根據△G=△H-T△S可知,當△G小于0時反應自發進行,由于反應NH3(g) + HCl(g) = NH4Cl(s)是熵值減小的反應,所以如果該反應在較低溫度下能自發進行,則說明該反應的△H<0,故B錯誤;C.因合成氨的反應是可逆反應,所以無法確定將7 g N2和3 g H2置于密閉容器中充分反應后,生成了多少NH3(g),故無法計算該反應的焓變,故C錯誤;D. 燃燒熱指的是1mol純物質完全燃燒生成穩定的氧化物時所放出的能量,所以生成的水應為液態,即甲烷燃燒的熱化學方程式應表示為CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故D錯誤;答案選A。


科目:高中化學 來源: 題型:
【題目】利用如圖所示裝置測定中和熱的實驗步驟如下:

①用量簡量取30mL0.50 molL-1硫酸倒入小燒杯中,測出硫酸溫度;
②用另一量筒量取50mL0.50molL-1NaOH溶液,并用同一溫度計測出其溫度;
③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測出混合液最高溫度。
回答下列問題:
(1)如果用30mL0.50mol/L硫酸與70mL0.50mol/LNaOH溶液進行反應,與上述實驗相比,所放出的熱量___________(填“相等”、“不相等”),所求中和熱___________(填“相等”、“不相等”),簡述理由_____________________。
(2)某實驗小組配制0.50mol/LNaOH溶液,若實驗中大約要使用245mLNaOH溶液,至少需要稱量NaOH固體_____________________g。
(3)若用KOH代替NaOH,對測定結果___________(填“有”或“無”)影響;若用醋酸代替HCl做實驗,對測定結果_____________(填“有”或“無”)影響。
(4)①近似認為0.50 molL-1硫酸和0.50 molL-1NaOH溶液密度都是1g·cm3,中和后溶液溫度上升了4℃,生成溶液的比熱容c=4.18J·(g·℃)-1,則中和熱△H=______(小數點后保留一位有效數字)。
②上述實驗結果與-57.3kJ·mol-1有偏差,產生偏差的原因可能是____________(填字母)。
A.實驗裝置保溫隔熱效果差
B.量取NaOH溶液體積時仰視讀數
C.分多次把NaOH溶液倒入盛有鹽酸的小燒杯中
D.用溫度計測定NaOH溶液起始溫度后直接測定鹽酸的溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F 是原子序數依次增大的短周期主族元素。E 是同周期金屬性最強的元素。甲、乙、丙、丁、戊是由上述部分元素中的兩種或幾種組成的化合物,它們之間的轉化關系如圖所示。其中甲是生活中的調味品,丁是淡黃色固體。下列說法不正確的是

A. 元素B的氫化物可能具有正四面體結構
B. 元素上的氧化物對應水物化的酸性一定比硫酸的酸性強
C. 原子半徑:r(E)>r(F)>r(C)>r(D)
D. 化合物A4BC2D既可能是共價化合物,也可是離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語正確的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的電離:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸鈣的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】全釩氧化還原電池是一種新型可充電池,不同價態的含釩離子作為正極和負極的活性物質,分別儲存在各自的酸性電解液儲罐中。其結構原理如圖所示,該電池放電時,右槽中的電極反應為:V2+-e-=V3+,下列說法正確的是

A. 放電時,右槽發生還原反應
B. 放電時,左槽的電極反應式:VO2++2H++e-=VO2++H2O
C. 充電時,每轉移1mol電子,n(H+)的變化量為1mol
D. 充電時,陰極電解液pH升高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于乙烯和乙烷的說法中,不正確的是
A.乙烯屬于不飽和烴,乙烷屬于飽和烴
B.乙烯中所有原子處于同一平面,乙烷中原子不在同一平面
C.乙烯分子中的碳碳雙鍵比乙烷中碳碳單鍵更穩定,不易發生化學反應
D.都可以使酸性高錳酸鉀溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A. 分子式為C3H6Cl2的有機物有4種同分異構體(不考慮立體異構)
B. ![]() 和
和![]() 互為同系物
互為同系物
C. 乙炔和溴的四氯化碳溶液反應生成1,2-二溴乙烷
D. 甲苯分子中所有原子都在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在電解煉鋁過程中加入冰晶石(用“A”代替),可起到降低Al2O3熔點的作用。冰晶石的生產原理為2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根據題意完成下列填空:
(1)冰晶石的化學式為____________, 含有離子鍵、____________等化學鍵。
(2)生成物中含有10個電子的分子是________(寫分子式),該分子的空間構型_______,中心原子的雜化方式為___________________。
(3)反應物中電負性最大的元素為________(填元素符號),寫出其原子最外層的電子排布圖:_______________。
(4)冰晶石由兩種微粒構成,冰晶石的晶胞結構如圖甲所示,●位于大立方體的頂點和面心,○位于大立方體的12條棱的中點和8個小立方體的體心,那么大立方體的體心處所代表的微粒是__________(填微粒符號)。
(5)Al單質的晶體中原子的堆積方式如圖乙所示,其晶胞特征如圖丙所示,原子之間相互位置關系的平面圖如圖丁所示:
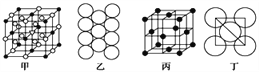
若已知Al的原子半徑為d,NA代表阿伏加德羅常數,Al的相對原子質量為M,則一個晶胞中Al原子的數目為___________個; Al晶體的密度為________(用字母表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:HCN(aq)與NaOH(aq)反應的△H=-12.1kJ /mol;HCl(aq)與NaOH(aq)反應的△H =-55.6kJ/ mol。則HCN在水溶液中電離的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com