
X、Y、Z、W、M均為短周期主族元素,原子序數依次增大,X 質子總數與電子層數相同,Y元素的一種同位素可用于考古時測定一些文物的年代,z的氣態氫化物可以與Cl2反應產生白煙,用來檢驗氯氣管道是否泄漏。Y、Z、W位于同一周期,且最外層電子數之和為15,M的質子數是X、Y、Z、W四種元素質子數之和的1/2,下列說法正確的是( )
A. 原子半徑M>W>Y>Z>X
B. 1molM2W2溶于足量的水中完全反應,共轉移2mol電子
C. X、Z兩種元素只能組成化學式為ZX3的化合物
D. 最簡單氣態氫化物的穩定性:W>Z>Y
科目:高中化學 來源:2016-2017學年山東省高一下學期開學考試化學試卷(解析版) 題型:選擇題
向BaCl2溶液中通入SO2氣體,沒有產生沉淀,繼續通入另一種氣體,產生沉淀,則通入的氣體不可能是( )
A. CO2 B. NO2
C. Cl2 D. NH3
查看答案和解析>>
科目:高中化學 來源:2017屆江西省九江市十校高三第二次聯考理科綜合化學試卷(解析版) 題型:選擇題
分子式為C4H10O的醇與分子式為C8H8O2且含苯環的羧酸在一定條件下反應生成酯的種類有( )
A. 4種 B. 8種 C. 12種 D. 16種
查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高一3月月考化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖所示。下列說法正確的是( )
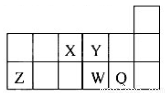
A. 離子Y2-和Z 3+的核外電子數和電子層數都不相同。
B. 原子半徑的大小順序為:rX>rY>rZ>rW>rQ。
C. 元素X與元素Z的最高正化合價之和的數值等于8。
D. 元素W的最高價氧化物對應的水化物的酸性比Q的強。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省大同市高一3月月考化學試卷(解析版) 題型:填空題
利用元素周期表,我們可以認識更多元素的性質
(1)元素周期表位于對角線的兩種元素其性質相似稱之為對角線規則。根據周期表對角線規律, 金屬Be單質及其化合物的性質與鋁單質及其化合物的性質相似。則鑒別說Be(OH)2和Mg(OH)2可選用的試劑為__________溶液。
(2)鉛(Pb)、錫(Sn)、鍺(Ge)與元素(C)、硅(Si)同主族,常溫下其單質在空氣中,錫、鍺不反應而鉛表面生成一層氧化鉛;鍺與鹽酸不反應,而錫與鹽酸反應。由此可得出以下結論:
① 鍺的原子序數為__________;
② 鉛(Pb)、錫(Sn)、鍺(Ge)的+4價氫氧化物的堿性由強到弱的順序為__________(填化學式)。
(3)最近,德國科學家實現了銣原子氣體超流體態與絕緣態的可逆轉換,該成果將在量子計算機研究方面帶來最重大突破。己知銣(Rb)是37號元素,質量數是85,與鈉同主族。回答下列問題:
①銣在周期表中的位置為___________________
②同主族元素的同類化合物的性質相似,請寫出:
AlCl3與過量的RbOH反應的離子方程式:_____________________________
③現有銣和另一種堿金屬形成的混合金屬50g,當它與足量水反應時,放出標準狀況下的氫氣22.4L,這種堿金屬可能是__________
A.Li B.Na C.K D.Cs
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省大同市高一3月月考化學試卷(解析版) 題型:選擇題
下列說法中不正確的是( )
①質子數相同的粒子一定屬于同種元素;
②同位素的性質幾乎完全相同;
③質子數相同,電子數也相同的兩種粒子,不可能是一種分子和一種離子;
④電子數相同的粒子不一定是同一種元素;
⑤一種元素只能有一種質量數;
⑥某種元素的相對原子質量取整數,就是其質量數
⑦元素周期表中從ⅢB族到ⅡB族10個縱行的元素都是金屬元素
⑧核外電子排布相同的微粒化學性質不一定相同
⑨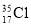 與
與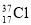 得電子能力相同
得電子能力相同
A. ①②④⑤ B. ③④⑤⑥ C. ②③⑤⑥ D. ①②⑤⑥
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三3月月考理科綜合化學試卷(解析版) 題型:簡答題
高鐵酸鉀(K2FeO4)是一種新型、高效、多功能水處理劑。
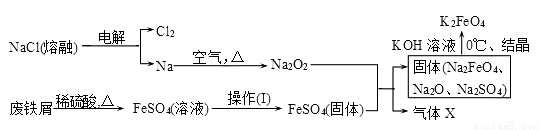
(1)工業上的濕法制備方法是用KClO與Fe(OH)3在KOH存在下制得K2FeO4,該反應氧化劑與還原劑物質的量之比為________________。
(2)實驗室用食鹽、廢鐵屑、硫酸、KOH等為原料,通過以下過程制備K2FeO4:
①操作(Ⅰ)的方法為_________________,隔絕空氣減壓干燥。
②檢驗產生X氣體的方法是________________。
③最終在溶液中得到K2FeO4晶體利用的原理是____________________。
(3)測定某K2FeO4樣品的質量分數,實驗步驟如下:
步驟1:準確稱量1.0g樣品,配制100mL溶液,
步驟2:準確量取25.00mL K2FeO4溶液加入到錐形瓶中
步驟3:在強堿性溶液中,用過量CrO2-與FeO42-反應生成Fe(OH)3和CrO42-
步驟4:加稀硫酸,使CrO42-轉化為Cr2O72-,CrO2-轉化為Cr3+,Fe(OH)3轉化為Fe3+
步驟5:加入二苯胺磺酸鈉作指示劑,用0.1000mol·L-1 (NH4)2Fe(SO4)2標準溶液滴定至終點(溶液顯紫紅色),記下消耗(NH4)2Fe(SO4)2溶液的體積,做3次平行實驗,平均消耗(NH4)2Fe(SO4)2溶液的體積30.00 mL。
已知:滴定時發生的反應為:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步驟2中準確量取25.00mL K2FeO4溶液加入到錐形瓶中所用的儀器是______________。
②寫出步驟3中發生反應的離子方程式__________________________。
③步驟5中能否不加指示劑_________,原因是________________。
④根據上述實驗數據,測定該樣品中K2FeO4的質量分數為__________。
(4)配制0.1mol·L-1的K2FeO4,調節溶液pH,含鐵離子在水溶液中的存在形態如圖所示。下列說法正確的是__________ (填字母)。
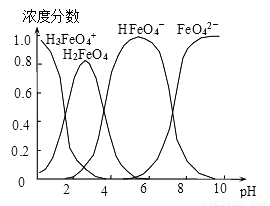
A.pH=2時,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的這種溶液中加硫酸銨,則HFeO4-的分布分數逐漸增大
C.向pH=1的溶液中加HI溶液,發生反應的離子方程式為:H2FeO4+H+=H3FeO4+
D.將K2FeO4晶體溶于水,水溶液呈弱堿性
查看答案和解析>>
科目:高中化學 來源:河北省2017屆高三下學期三調考試理科綜合化學試卷 題型:選擇題
用NA表示阿伏伽德羅常數的值,下列敘述中不正確的是
A. 28g由乙烯和環丁烷(C4H8)組成的混合氣體中含有的碳原子數為2NA
B. 常溫下,1L0.5mol/LFeCl3溶液中含有的Fe3+數目一定小于0.5NA
C. 92g由NO2和N2O4組成的混合氣體中含有的原子總數為6NA
D. 22.4L氯氣與足量鎂粉充分反應后,轉移的電子數為2NA
查看答案和解析>>
科目:高中化學 來源:2017屆新疆烏魯木齊地區高三第二次診斷性測驗化學試卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A. Na2S溶液中:SO42-、K+、Cl-、Cu2+
B.  的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+
C. 飽和氯水中:Cl-、NO3-、Na+、SO32-
D. 碳酸氫鈉溶液:K+、SO42-、Cl-、H+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com